
Introducción
Clásicamente, los eritrocitos al ser células carentes de orgánulos y de información genética, se han considerado como meras bolsas lipídicas conteniendo hemoglobina e implicadas solamente en el transporte de gases por la sangre. Pero, para los inmunólogos son mucho más que células imprescindibles para la respiración, pues existe un gran vínculo entre los componentes del sistema inmunitario y los glóbulos rojos de la sangre. Y que viene de lejos, pues es bien sabido que los eritrocitos, junto con neutrófilos, monocitos, ciertos linfocitos, los podocitos del glomérulo renal y los nervios periféricos, expresan el receptor 1 del complemento (CR1, CD35). Este receptor, además de actuar como inhibidor del complemento y proteger nuestras propias células, es el fundamento de la adherencia inmunológica y la base para la eliminación de patógenos inmovilizados formando inmunocomplejos en su tránsito por el bazo y el hígado. Así, este CR1 es eliminado junto con el inmunocomplejo opsonizado, sin dañar al eritrocito. De hecho, dada la importancia del proceso, sobreexpresiones, polimorfismos u otras alteraciones de CR1 están claramente implicadas en la severidad del lupus eritematoso sistémico. Además, como dato curioso, este CR1 es el responsable de las famosas rosetas de hematíes y que han sido tan importantes para el laboratorio de inmunología y que in vivo sirven para acelerar la destrucción de patógenos por los macrófagos. También ese CR1 es la puerta de entrada del Plasmodium falciparum al eritrocito y además, contribuye a la patogénesis cerebral de la malaria.
El segundo vínculo entre sistema inmunitario y los eritrocitos es por el reciclado de los valiosos componentes citosólicos de los mismos, a saber, el hierro y el grupo hemo. En él participan los macrófagos de la trama retículoendotelial, principalmente los del bazo e hígado. El mácrófago fagocita a los hematíes defectuosos, dañados o sencillamente senescentes (la vida media son de 120 días) y facilita que la transferrina lleve al hierro a la médula ósea para hacer viable la eritropoyesis. Así mismo, el metabolismo intracelular de la hemoglobina en el macrófago produce valiosos aminoácidos pero también, al despojarse el grupo hemo del hierro, una enzima con actividad oxigenasa lo convierte en biliverdina y posteriormente una reductasa la transforma en bilirrubina, que unida a la albúmina llegará al hígado para formar parte de las sales biliares y sus funciones asociadas.
Pero, este dogma de la fisiología de considerar a los hematíes como carentes de actividad por si mismos está cambiando pues cada vez se les están atribuyendo nuevas funciones y, como no podía se de otra forma, se les están atribuyendo otros roles muy importantes en la modulación de la respuesta inmunitaria. Y mucho de este cambio viene de la mano, como no, de la infección por coronavirus. Para que nos hagamos una idea de lo importante que puede ser para el organismo, tengamos en cuenta que los eritrocitos son el tipo de célula más abundante en el cuerpo humano, con un número de entre 20 y 30 billones y que representa casi el 70 u 80% del recuento total de células en el adulto medio.
Una pincelada evolutiva
Para empezar, desde una perspectiva evolutiva la participación de los eritrocitos humanos en la inmunidad innata no debería sorprender, ya que los eritrocitos nucleados de aves, anfibios y peces participan activamente en la respuesta inmunitaria a través de la producción de citocinas, regulación positiva de los genes de respuesta viral y secuestro de patógenos a través de la unión a su superficie o incluso la fagocitosis. Pero es importante destacar que los mamíferos son los únicos vertebrados cuyos eritrocitos están enucleados en su estado maduro. La extrusión del núcleo y otros orgánulos se produce a través de una serie de etapas complejas, que incluyen la condensación de cromatina y la mitofagia. Se cree que la pérdida del núcleo eritroide ha facilitado la adaptación de los mamíferos a una tierra con menores presiones parciales de oxígeno, ya que permitió que los eritrocitos se especializaran aún más para un intercambio de gases eficiente, pues las demandas metabólicas de la endotermia son altísimas. Veamos las consecuencias: la deleción de núcleos y orgánulos en eritrocitos maduros puede haber permitido un aumento de la relación área de membrana y volumen celular, lo que facilita una mayor eficiencia de intercambio de gases; permitió portar una mayor cantidad de hemoglobina dentro de la celular; proporcionó una mayor flexibilidad al eritrocito y una capacidad mejorada para atravesar pequeños capilares.
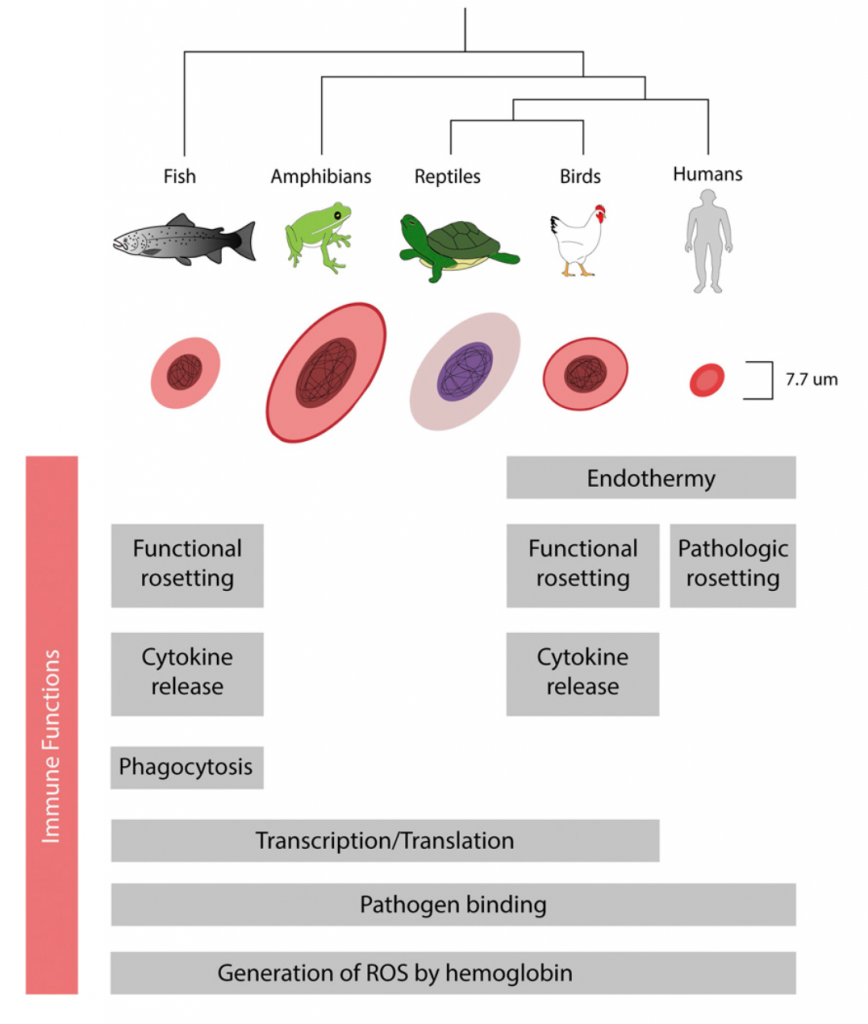
De acuerdo con esta idea, los eritrocitos son comparativamente más grandes en organismos ectotérmicos como peces y reptiles. Debido a que la endotermia surgió por separado en los linajes de aves y mamíferos, tal vez sea de esperar que la acompañen conjuntos alternativos de adaptaciones fisiológicas. Eso si, esta simplificación estructural hace que las vidas medias de los eritrocitos con núcleo sean entre 4 y 12 veces superiores.
El eritrocito de mamífero y la inflamación
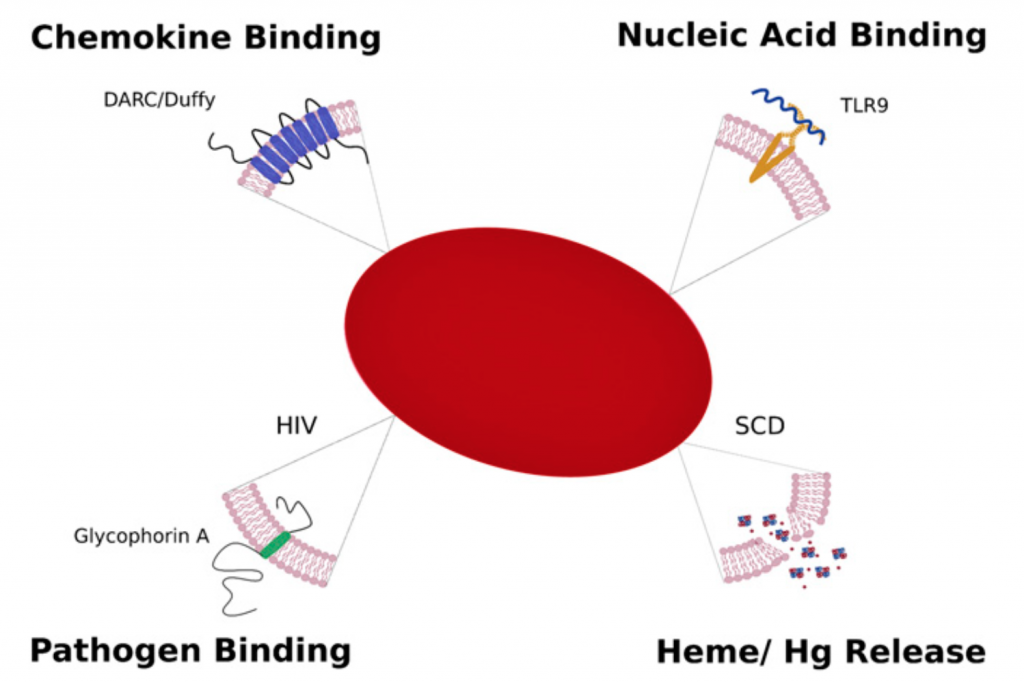
A pesar de la eliminación de orgánulos durante la eritropoyesis y la posterior incapacidad para realizar la transcripción y traducción, los eritrocitos de mamíferos conservan la capacidad de interactuar con moléculas inflamatorias endógenas y exógenas en la sangre. Las investigaciones de la última década demuestran que, al igual que sus contrapartidas evolutivas, estas células conservan la capacidad de unirse e interactuar con quimiocinas, ácidos nucleicos y patógenos, regulando y modulando así las respuestas inmunitarias. Los componentes internos de los eritrocitos, como la hemoglobina y el hemo, también son facetas formidables de la inmunidad innata, capaces de generar especies reactivas de oxígeno (ROS) antimicrobianas para defenderse de los microbios hemolíticos invasores y promover respuestas patológicas inflamatorias y autoinmunes.
La implicación de la formación de rosetas de los eritrocitos de aves contrasta fuertemente con el de los eritrocitos humanos y, como ejemplo, la infección por Plasmodium falciparum. La formación de rosetas en este contexto se caracteriza no como un mecanismo de defensa del huésped humano, sino más bien como un mecanismo de virulencia del parásito de la malaria.
Finalmente, la participación de los eritrocitos en las interacciones huésped-patógeno puede hacerlos de importancia crucial en el contexto de sepsis y choque séptico, un estado de respuesta del huésped desregulada a la infección donde el cuerpo está abrumado por endotoxinas y otros mediadores inflamatorios. Es probable que una comprensión más profunda de la función de los eritrocitos sea vital para dilucidar las formas en que estas células contribuyen a la patogénesis de una variedad de enfermedades agudas y crónicas.
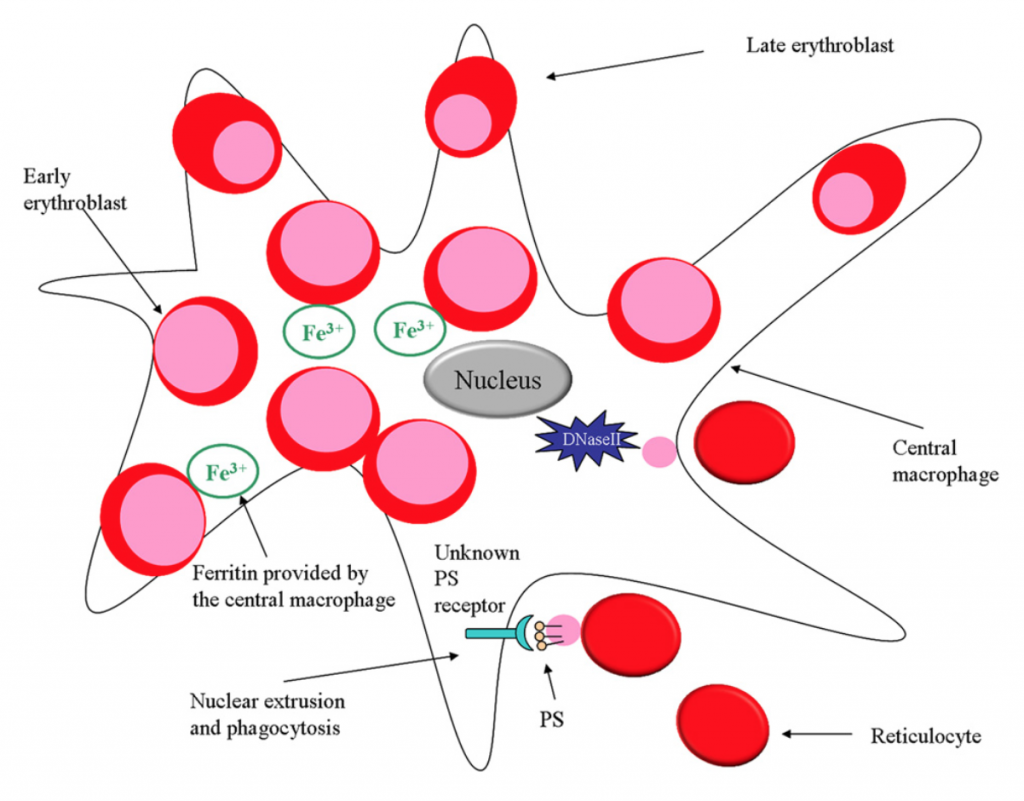
La interacción entre macrófagos y eritrocitos es más compleja de lo que parece
Los macrófagos no solo controlan la funcionalidad de los eritrocitos, sino la vida media, su reciclado y captan los antígenos que ellos presentan de alguna forma. Además los macrófagos presentes en al médula ósea son en parte responsables de una correcta eritropoyesis. Cada hora producimos alrededor de 1010 hematíes y los macrófagos no sólo fagocitan los núcleos expulsados de la células rojas de la sangre, sino que participan también activamente y regulando el proceso. La interacción célula a célula mediante moléculas de adhesión va a ser muy importante para el mantenimiento de las llamadas islas eritroblásticas en la médula ósea. Pero la liberación de citocinas va a ser crucial para la homeostasis de ese microambiente y las relaciones entre macrófagos y progenitores. En este sentido, los eritroblastos secretan factores eritropoyéticos positivos como PGF, VEGF, mientras que los macrófagos regularían negativamente el proceso liberando IL-6, TNF-α, TFG-β e IFN-ɣ. Esta retroalimentación parece bastante obvia, si el macrófago fagocita muchos núcleos, será que la eritropoyesis va a toda máquina y lo más conveniente será reprimirla un poco.
Patógenos sobre los eritrocitos
Existe un amplio espectro de parásitos que invaden específicamente los eritrocitos de los vertebrados, causando un conjunto diverso de enfermedades en el organismo huésped. Los reptiles son el grupo más afectado por la variedad de parásitos conocidos del linaje de los protozoos además de otros procariotas y virus. A excepción de la biología de las especies de Plasmodium, donde se conocen más de 200 y casi la mitad de estas especies se dirigen a los lagartos, hay una laguna significativa de conocimiento sobre muchas de las patologías relacionadas con los eritrocitos y sus patógenos.
Lo que si que conocemos bien son las bacterias hemolíticas, que quieren robarle al organismo el preciado cargo que portan los hematíes, principalmente el hierro. En respuesta, la hemoglobina del huésped proporciona un contraataque pues las proteasas extracelulares de las bacterias rompen ésta en péptidos que generan ROS con papel bactericida. Además se ha visto que las subunidades α y β de la hemoglobina contienen sitios de unión de alta afinidad para LPS y que estimula la actividad redox de los péptidos generados y conduce a la producción de radicales libres antimicrobianos. Por último, se ha demostrado que la presencia de hemoglobina junto con LPS mejora la unión de los macrófagos a la toxina y amplifica en estos la producción de citocinas.
El papel paradójico de los eritrocitos y las especies reactivas de oxígeno
En condiciones fisiológicas, los glóbulos rojos van muy bien equipados de maquinaria antioxidante, como el glutatión reducido, la tiorredoxina, el ácido ascórbico y la vitamina E, de forma que actúan como captadores circulantes de ROS y nitrógeno generadas en la vasculatura. Pero, por contra, si los glóbulos rojos cruzan un tejido donde tiene lugar una producción intensa de ROS se puede invertir su papel. El estrés oxidativo causa una plétora de cambios en los glóbulos rojos entre los que se encuentran el reordenamiento y oxidación del citoesqueleto y la pérdida de asimetría de lípidos. Estas células se vuelven más rígidas y, por lo tanto, se lisan más fácilmente liberando hemoglobina, grupo hemo-Fe, hierro y otras especies citotóxicas en la vasculatura. Todas estas moléculas son potentes oxidantes y fuentes de radicales y son capaces de activar de forma proinflamatoria las células inmunitarias innatas y las células endoteliales mismas. Por si fuera poco, se producen alteraciones en proteína banda 3 que asemejan un estado senescente en los eritrocitos favoreciendo la equinocitosis y eritrofagocitosis por los macrófagos. Aún más, la pérdida de glicoforina A y la translocación de la fosfatidilserina condice a la eferocitosis de los hematíes.
Una nueva forma de matar y presentar antígenos
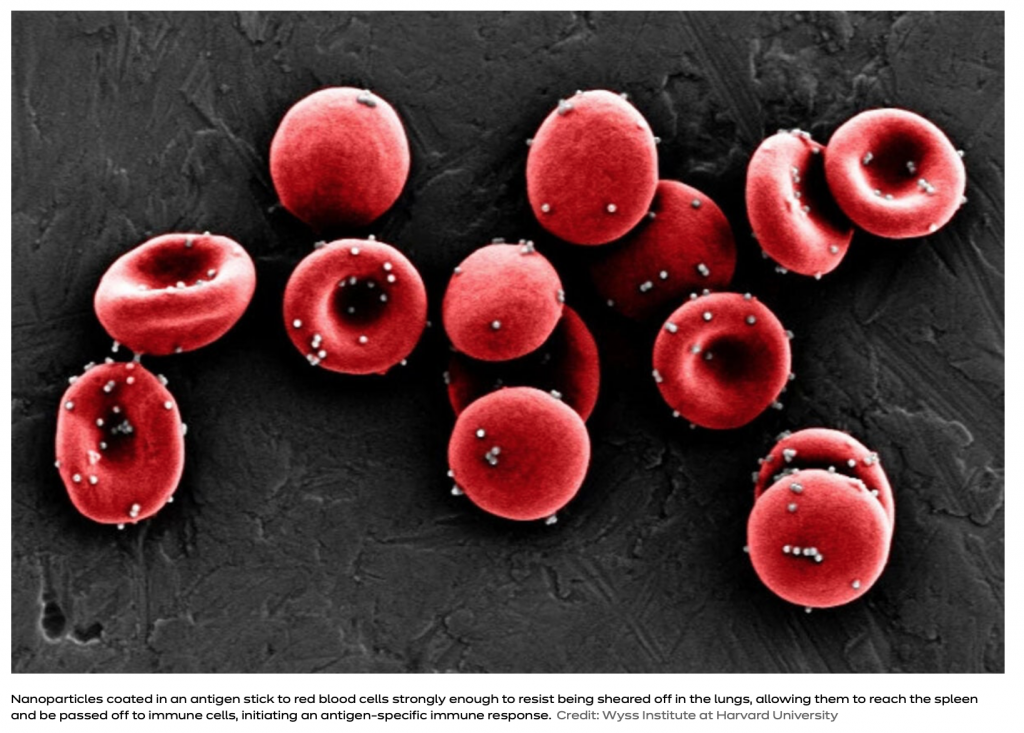
Algunas especies de Staphylococcus y Propionibacterium se anclan a la membrana de eritrocito mediante interacciones electrostáticas y mueren mediante un proceso inducido por los hematíes, denominado oxicitosis. Brevemente, es un mecanismos de muerte generado por la liberación de oxígeno molecular por la oxihemoglobina. Las bacterias destruidas continúan pegadas a la membrana y son transportadas a los órganos linfoides secundarios de forma segura, donde son fagocitados por células presentadoras de antígenos sin dañar a los mismos glóbulos rojos. El proceso es tan relevante para la inmunidad innata que las formas más importantes que tiene para eliminar patógenos es la fagocitosis en los tejidos y la oxicitosis en la sangre periférica. Recuerda en cierta medida al receptor de patrones DC-SIGN en las células dendríticas. De hecho la biotecnología ha desarrollado estrategias biomimética que convierten a los eritrocitos en portadores encapsulados mediante adsorción u otro tipo de interacciones de fármacos, proteínas o nanopartículas.
Implicación de los eritrocitos en diversas patologías
La eritropoyetina (EPO) es la hormona que estimula la producción de eritrocitos en la médula ósea y ahora sabemos que tiene una influencia muy importante en la inflamación. Además de los progenitores eritroides, otros leucocitos presentan el receptor de la EPO (EPOR) cuya función era una auténtica incógnita hasta hace una década. La señalización a través de EPOR produce una disminución de NF-κB por lo que no solo se reduce la inflamación sino también la liberación de todo tipo de citocinas. Ello es un arma de doble filo pues en procesos donde la inflamación subyacente está implicada en la patología, la administración de EPO podría ayudar a controlar la progresión de la misma, eso sí, aumentando el hematocrito del enfermo. Por contra, en otros procesos infecciosos hemolíticos, la secreción renal de EPO podría agravar la situación del paciente.
Aunque la hemoglobina puede conferir protección antimicrobiana en condiciones homeostáticas, en presencia de LPS, lo que en realidad estimula es la producción de TNF-α de los macrófagos y desencadena la liberación de citocinas proinflamatorias. Es probable que estos efectos sean atribuibles a la capacidad de la globina para eliminar el exceso de hemo libre durante la endotoxemia. El grupo hemo también se ha caracterizado in vitro como una potente señal de peligro, capaz de activar la expresión mediada por NF-κB de proteínas proinflamatorias (IL-1 y TNF-α) y generación de ROS intracelulares. Además el grupo hemo libre es un activador independiente de TLR4, que en los macrófagos subsecuentemente estimula la secreción de TNF-a, ROS y leucotrienos. Si el grupo hemo se localiza en el hígado, también induce la liberación de la alarmina HMGB1 de los núcleos de hepatocitos.
En otro orden de cosas, los eritrocitos también se anclan en las placas de ateroma. Allí se rompen y contribuyen a la inestabilidad de la misma, no solo por el depósitos de los lípidos de su membrana sino a la dañina oxidación de las liporoteínas merced a su hemoglobina liberada y rica en oxígeno. Sabemos que los lípidos oxidados son reconocidos por scavenger receptors y promueven el ambiente inflamatorio.
La implicación en la infección por SAR-CoV-2
Los niveles elevados de DNA libre o de promotores ricos en CpG o del mismo DNA mitocondrial es una marca constitutiva de infección o del propio daño tisular (inflamación estéril). De hecho, estos patrones o alarminas activan a los macrófagos que fagocitan más intensamente a los eritrocitos y se han asociado con la anemia observada en casos de sepsis, neumonía, malaria o infecciones graves. El grupo de Mangalmurti recientemente ha demostrado que los eritrocitos al expresar altos niveles de TLR9 funcionarían también como basureros y eliminan ácidos nucleicos libres, haciendo desaparece estas señales inflamatorias. Este efecto es especialmente relevante en el tejido pulmonar lo que dificulta el proceso inflamatorio, favoreciendo la homeostasis del sistema inmunitario. El mismo grupo demuestra este año en un artículo en Sci. Transl. Med. que en la covid-19, un déficit de esta función sería un factor más propio del huésped que agravaría la sintomatología de la enfermedad. Hallaron que el DNA mitocondrial unido a glóbulos rojos estaba elevado en individuos con neumonía viral y sepsis secundaria a la enfermedad por coronavirus y se asoció con anemia y gravedad de la enfermedad.
Por lo tanto, gracias al TLR9 los glóbulos rojos funcionarían como auténticos centinelas inmunes durante los estados patológicos. Este mecanismo inmunitario innato puede ser tanto beneficioso en la eliminación de los glóbulos rojos dañados, como que probablemente contribuya a la inflamación sistémica y al desarrollo de anemia durante estados patológicos en los que el DNA libre de células está elevado.
Corolario
Durante mucho tiempo se asumió que los glóbulos rojos eran portadores inertes de oxígeno, pero están emergiendo como importantes moduladores de la respuesta inmunitaia innata. Dependiendo de las condiciones del microambiente, los eritrocitos pueden promover la activación inmunitaria o mantener su quiescencia. Dado el éxito limitado de las terapias inmunomoduladoras en el tratamiento de enfermedades inflamatorias, tal vez incidir sobre los eritrocitos sea una alternativa en la busca de tratamientos que mitiguen o controlen estas enfermedades.
Referencias
Lam, L. K. M., Murphy, S., Kokkinaki, et al. (2021). DNA binding to TLR9 expressed by red blood cells promotes innate immune activation and anemia. In Sci. Transl. Med (Vol. 13).
de Back, D. Z., Kostova, E. B., van Kraaij, M., van den Berg, T. K., & van Bruggen, R. (2014). Of macrophages and red blood cells; A complex love story. In Frontiers in Physiology: Vol. 5 JAN. https://doi.org/10.3389/fphys.2014.00009
Anderson, H. L., Brodsky, I. E., & Mangalmurti, N. S. (2018). The Evolving Erythrocyte: Red Blood Cells as Modulators of Innate Immunity. The Journal of Immunology, 201(5), 1343–1351. https://doi.org/10.4049/jimmunol.1800565
Ukidve, A., Zhao, Z., Fehnel, A., Krishnan, V., Pan, D. C., Gao, Y., Mandal, A., Muzykantov, V., & Mitragotri, S. (n.d.). Erythrocyte-driven immunization via biomimicry of their natural antigen-presenting function. https://doi.org/10.1073/pnas.2002880117/-/DCSupplemental
Morera, D., & MacKenzie, S. A. (2011). Is there a direct role for erythrocytes in the immune response? In Veterinary Research (Vol. 42, Issue 1). https://doi.org/10.1186/1297-9716-42-89
Buttari, B., Profumo, E., & Riganò, R. (2015). Crosstalk between red blood cells and the immune system and its impact on atherosclerosis. In BioMed Research International (Vol. 2015). Hindawi Publishing Corporation. https://doi.org/10.1155/2015/616834
Stosik, M., Tokarz-Deptuła, B., Deptuła, J., & Deptuła, W. (2020). Immune Functions of Erythrocytes in Osteichthyes. In Frontiers in Immunology (Vol. 11). Frontiers Media S.A. https://doi.org/10.3389/fimmu.2020.01914

2 comments for “Nuevas implicaciones de los eritrocitos en la respuesta inmunitaria y su influencia en la patogénesis de la covid-19”