Los virus emergentes y sus epidemias
Los virus conocidos o los virus emergentes amenazan y desafían la salud pública mundial y producen problemas económicos muy costos para la sociedad. Un ejemplo es el influenzavirus A, el agente causal de la gripe y uno de los patógenos humanos más importantes, cuyos efectos de la infección varían de leve a grave e incluso puede causar la muerte. Sus virus estacionales pueden ocasionar epidemias anuales que resultan entre 3 a 5 millones de casos de enfermedades graves y de 290 000 a 650 000 muertes. Y este escenario puede ser aún peor durante un año de pandemia. El brote más virulento de la historia fue el de la llamada gripe española H1N1 de 1918, inusualmente grave, que infectó aproximadamente el 5% de la población mundial y mató al 2%, unos 50 millones de personas.
Imagen del virus de la gripe
Por cierto, le llamaron gripe española al ser España un país neutral durante la primera guerra mundial y ser los primeros en reportar los casos de esta epidemia. Los otros países también la sufrían, pero por cuestiones tácticas bélicas no publicaban estos hechos epidemiológicos ni su mortalidad. La falta de antibióticos para combatir las infecciones secundarias y los factores socioeconómicos pudieron ser relevantes, pero la infección experimental de primates con el virus reconstruido de 1918 sugiere que la naturaleza letal del virus en sí fue un factor importante. De hecho, es el único virus de la gripe letal para primates y, a diferencia de otras cepas, es capaz de suprimir las respuestas inmunes innatas. Las tasas de letalidad de la gripe asiática H2N2 de 1957, la gripe H3N2 de Hong Kong de 1968 y la pandemia de H1N1 de 2009 fueron afortunadamente menores, estimándose en un 0.2% o menos. Pero algo aún más alarmante, entre 1997 y 2014, varios virus de la influenza aviar epizoótica sin precedentes (p. ej., H5N1, H7N9 y H10N8) cruzaron la barrera de las especies para causar la enfermedad en humanos. Los virus H5N1 que circulan ahora causan una infección pulmonar grave similar a la causada por el virus de 1918 y también suprimen la inmunidad innata, por lo que las terapias que protegen este tipo de inmunidad del huésped podrían reducir la gravedad de la infección debido a estos virus de la influenza.
La gripe y su clínica
La gripe cursa con enfermedad respiratoria febril y la transmisión del virus se produce fácilmente por la vía aérea o por contacto directo. En individuos no inmunes el virus se multiplica rápidamente en las células epiteliales a lo largo de todo el tracto respiratorio, mientras que la propagación del virus fuera de las vías respiratorias es extremadamente rara. En este sentido es de destacar que los pulmones son aún más susceptibles que el tracto respiratorio superior. La enfermedad generalmente comienza dentro de las 18 ± 72 h después de la infección y las biopsias nasales y bronquiales nos muestran una degeneración y descamación de células epiteliales y una marcada infiltración de neutrófilos. La degeneración del epitelio de las vías respiratorias y la aparición de la enfermedad son extremadamente rápidos, pero también lo es su regeneración y la recuperación clínica y el aclaramiento viral ocurren frecuentemente dentro de los 7 días post-infección.
Hoy en día, el tratamiento con antivirales y la prevención mediante vacunas tienen una efectividad limitada. El virus muta y por ende cambia rápidamente sus antígenos inmunogénicos debido a deriva genética (mutaciones puntuales en los genes de los antígenos) y por cambio antigénico (cambios de un gen completo entre distintas variantes de un virus) lo que le llevan al escape inmunológico.
¿Pero, por qué fue tan destructiva la pandemia de 1918?
A pesar de la intensa investigación clínica y patológica de la infección, nuestra comprensión de los mecanismos del desarrollo de la enfermedad aún está incompleto. En caso de infección por influenzavirus A, la gravedad de la enfermedad es el resultado de la interacción entre la virulencia viral y la resistencia del huésped. En una infección leve, el huésped tiene una respuesta inmunitaria limitada o moderada, restableciendo rápidamente la homeostasis. Sin embargo, para infecciones causadas por las influenzas H1N1 o H5N1 la respuesta inflamatoria se volvió hiperactiva, lo que resultó en un exceso reacción y un control insuficiente de las misma, una combinación de eventos llamados «tormenta de citocinas» o más precisamente síndrome de liberación de citocinas (CRS, cytokine release syndrome). Las células epiteliales del aparato respiratorio son las primeras dianas del virus de la gripe y también son las células iniciadoras del CRS. Esta tormenta de citocinas se correlaciona directamente con la lesión del tejido y un pronóstico desfavorable.
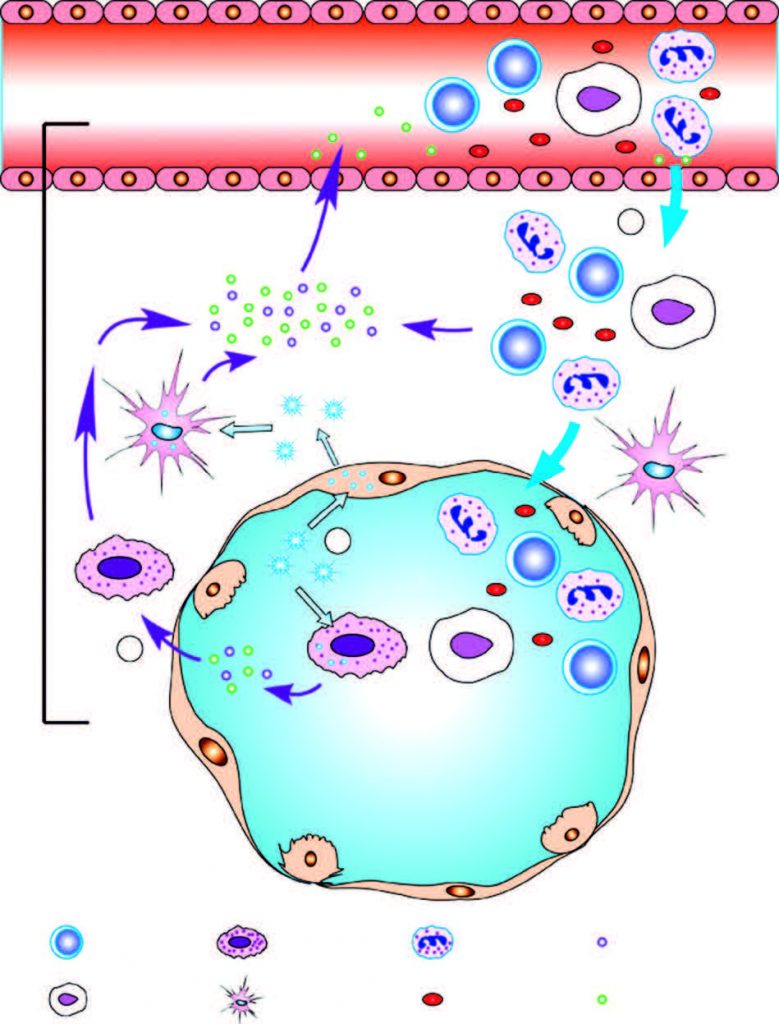
Liu Q, Cellular & Molecular Immunology (2016)
Sin embargo, a pesar de la relevancia del proceso, nuestro entendimiento del mecanismo que promueve una tormenta de citoquinas sigue siendo limitado. En este contexto, existen evidencias de que las citocinas proinflamatorias son la causa de una parte importante de la sintomatología y del deterioro del paciente. Una actividad descontrolada de estas citocinas podría estar detrás de que la infección por el virus de la gripe no sea, como lo es en la gran mayoría de los pacientes, un hecho auto-limitado y sin complicaciones con síntomas clínicos leves, sino un cuadro más complicado y severo con neumonía o insuficiencia respiratoria aguda que requiere hospitalización.
Las citocinas y la tormenta de citocinas
Las citocinas son pequeños péptidos que actúan como mensajeros intercelulares. Como el sistema inmunitario está formado por una extensísima trama de tejidos y células dispuesto por el organismo o en circulación, la red de citocinas que actúan sobre el mismo es muy extensa. Estas citocinas, que son liberadas por leucocitos u otras células (principalmente epiteliales), van a mediar en el ámbito local y de forma autocrina y paracrina cualquier tipo de cambio en la fisiología de la célula, desde la proliferación hasta la apoptosis y de la migración celular. Pero hay un grupo de citocinas que denominamos pro-inflamatorias que actúan tanto de forma local con el fin de activar y reclutar células al tejido infectado como de forma sistémica regulando el centro termorregulador del hipotálamo posterior y la liberación de mediadores inmunológicos por el hígado. Estas citocinas son la interleucina 1 (IL-1), la IL-6 y el factor de necrosis tumoral alfa (TNF-α). A la vez que se produce esta respuesta inflamatoria, con el fin de contenerla y permitir la homeostasia inmunitaria se liberan citocinas inmunorreguladoras como la IL-10 y el factor de crecimiento transformante beta (TGF-beta). Para preservar la integridad tisular, o incluso la viabilidad del individuo, es vita que esté bien equilibrado este binomio pro y anti-inflamatorio.
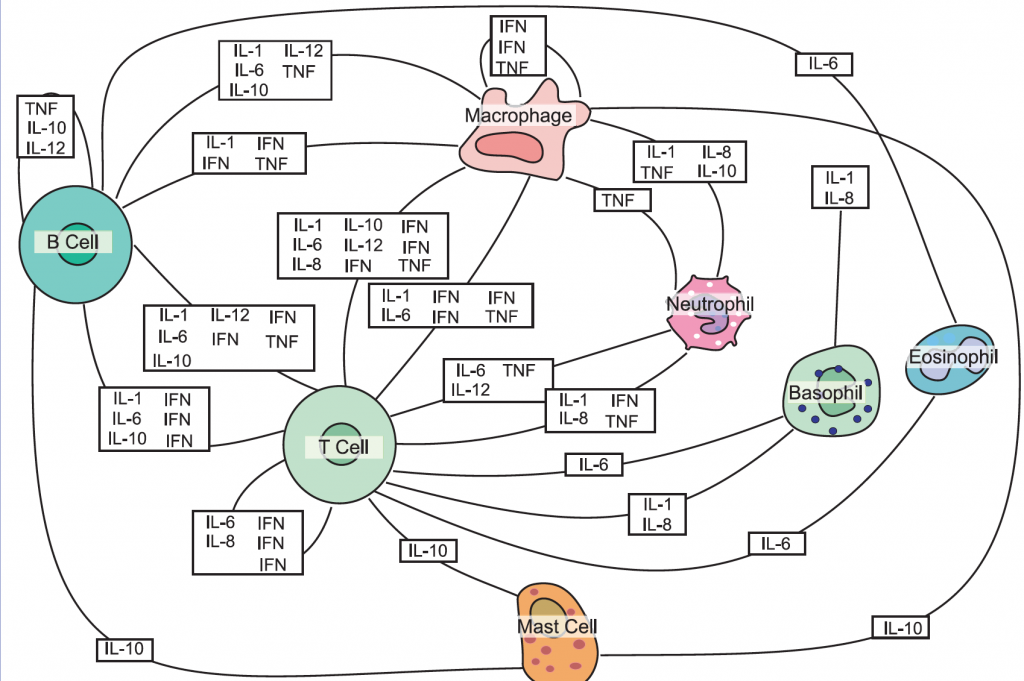
Sladkova, Acta Virologica 2006.pdf
La tormenta de citocinas se caracteriza por la liberación masiva e incontrolable de IL-1, IL-6 y TNF-α e incluso IFN-gamma. Esta se origina como respuesta al daño producido por varios microorganismos, y a ciertas moléculas que producen como los superantígenos. Pero esta tormenta también se puede dar ante intervenciones terapéuticas como la sucedida con anticuerpos monoclonales anti-CD28 o la que se da en algunos pacientes tratados con CAR-T. En estos casos, ya que la respuesta es sistémica (según la vía de administración del fármaco) la tormenta es tan brutal que el paciente necesita ingresar en la UCI en una situación crítica. Por el contrario, ante patógenos localizados en un tejido dado, esta tormenta provocará un reclutamiento y activación masiva de macrófagos y linfocitos que pueden destruir o desestabilizar los vasos sanguíneos y el tejido. En el caso del influenzavirus A dañando el tejido del aparato respiratorio y en menor medida el epitelio gastrointestinal. Veamos por que.
¿Cómo responde el sistema inmunitario contra el virus?
El virus de la gripe humana produce infecciones del tracto respiratorio y tras la invasión viral de las células epiteliales respiratorias y los macrófagos alveolares, estos responden generando alarminas, interferones e inflamación y activando tanto las respuestas inmunitarias innatas y adquiridas. Las innatas intentarán de forma casi inmediata de contener la replicación y diseminación viral mientras que las segundas necesitarán su tiempo pues precisan de expansiones clonales de células antígeno específicas. Los anticuerpos neutralizarán la diseminación viral a la vez que impedirán que nuevos virus infecten células sanas y por otro lado los linfocitos citotóxicos destruirán las células infectadas por los virus. Pero el virus es persistente y resistente por lo que la llamada inflamatoria se prolongará demasiado en el tiempo generando ese bucle que se retroalimenta y resultado en la liberación masiva de citocinas y el daño a los tejidos del huésped. En la sangre se han podido cuantificar incrementos de IL-6 hasta de 19 veces, a la vez que drásticas reducciones de IFN-α (que son los responsables de la defensa antiviral innata). Además, los macrófagos, las células dendríticas y neutrófilos reclutados al pulmón producían excesivas cantidades de IL-1, TFN-α e IFN-gamma.
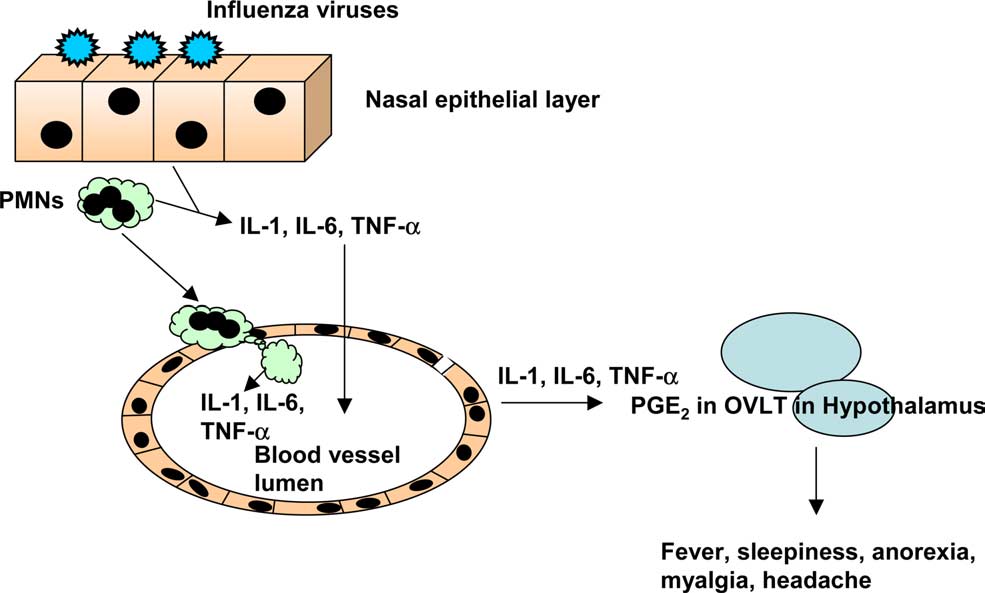
Brydon, FEMS 2005
Los estudios in vivo de la infección por el virus de la gripe han sido principalmente
realizado en ratones y cerdos donde en el líquido de lavado broncoalveolar (BAL) u homogenados de pulmón se han descrito aumentos en IFN-α, TNF-α, IL-1 e IL-6. Estos estudios en humanos han demostrado incrementos también de quimicinas como MIP-1 (macrophage inflammatory protein) y MCP-1 (monocyte chemoattractant proteins).
Todo este escenario conduce a que la capacidad de intercambio gaseoso esté seriamente disminuida debido a la insuficiencia respiratoria (síndrome de dificultad respiratoria aguda, SDRA o ARDS en inglés) y que todo el organismo vaya a sufrir esa hipoxia llevando a que muchos sistemas fallen.
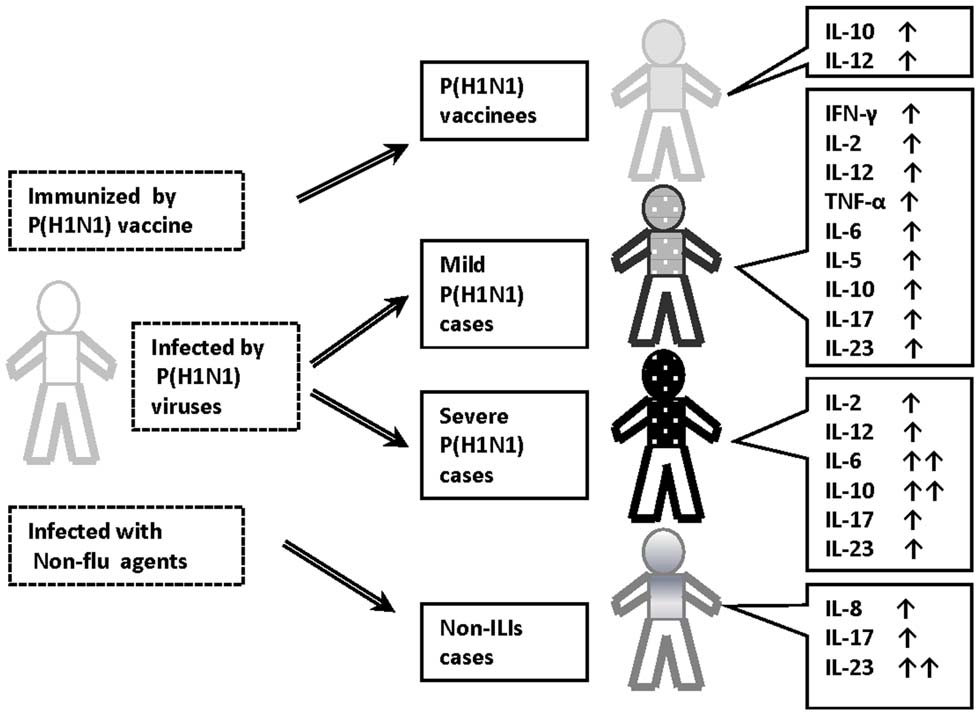
Yu X, PLoS ONE 2011
La patogenicidad del virus de la gripe A
Pero viendo la patogenicidad de los distintos tipos de brotes observamos que no todos se comportan con los mismos niveles de morbilidad y mortalidad. Y la gran cuestión es a que se pueden deber estas diferencias. Veamos las más importantes:
– Una de ellas es el desarrollo de medicina según regiones geográficas y el acceso a antibióticos para tratar otras infecciones oportunistas, antivirales o medios para paliar el SDRA.
– Las características de los pacientes como la edad, el sexo, otras enfermedades preexistentes y que modulan por un lado la capacidad de respuesta inmunitaria y por otro la capacidad vital de respuesta antiviral.
– Otras son inherentes al tipo de virus, su tropismo y su capacidad de bloquear la respuesta inmunitaria innata antiviral (a los interferones principalmente).
– Además, están las diferencias y semejanzas con otras variantes que hayan afectado a grupos poblacionales y la inmunidad generada. La respuesta adaptativa inmunitaria produce anticuerpos neutralizantes contra sus dos glicoproteínas de membrana más importantes, la hemaglutinina (HA) y la neuraminidasa (NA).
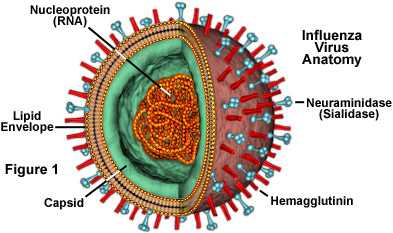
Detalle molecular del influenzavirus A
Como son moléculas muy sujetas a la deriva antigénica, no paran de surgir variantes y por ello es difícil tener memoria inmunológica efectiva contra los distintos virus de la gripe que aparecen en cada estación, aumentando con ello el riesgo de epidemias o pandemias. Aunque eso sí, cuanto más mayor es un individuo, mayor probabilidad de tener anticuerpos que reconozcan de alguna forma las variantes del virus y confieran algún tipo de protección, aunque no sea total. Por ejemplo, en la pandemia de gripe de 1918-19 el grupo de sujetos con mayor índice de mortalidad era entre los 20 y 40 años de edad. De igual forma en la de 2009 la menor mortalidad se observó en individuos mayores y la mitad de los pacientes que necesitaron hospitalización o murieron eran personas jóvenes sin patologías previas.
Implicaciones clínicas y terapéuticas y su traslación a la pandemia por Covid-19
El coronavirus SARS-CoV-2 es el agente causal de la pandemia denominada Covid-19. En una entrada de este blog ya hemos tratado las características inmunorreguladoras de este virus. Pero recientes investigaciones han puesto de manifiesto que la inmunopatogenia viral no se reduce únicamente a estrategias que le conducen al escape inmunológico del mismo sino al desencadenamiento de una tormenta de citocinas local sobre el tejido pulmonar. Luego la semejanza en la histopatología de ambas enfermedades virales es muy alta así como la insuficiencia respiratoria que producen.
En primer lugar, para diagnosticar y tratar eficazmente las infecciones graves por el virus de la influenza y coronavirus, es importante determinar el estado de la infección y la calidad de la respuesta inmune del hospedador. Por ello son cruciales biomarcadores específicos que permitan un diagnóstico preciso de la enfermedad y tengan un valor pronóstico para predecir la gravedad de la enfermedad. Identificar los biomarcadores de la infección por la gripe A es un desafío, ya que muchos factores virales y celulares influyen en la virulencia, la respuesta del huésped y la patogenicidad del virus. La hemaglutinina, la neuraminidasa, la NS y los productos génicos de polimerasa PB1 y PB2 desempeñan un papel central en la determinación de la virulencia. E identificar los biomarcadores de Covid-19 y sus determinantes de virulencia son aún son un desafío mayor, debido lo recientes que de la pandemia, su alta letalidad y a la necesidad urgente de tenerlos para manejar lo más eficientemente a nuestros pacientes. Que, en este caso, de forma contraria a lo que sucedía en la gripe A, lo pacientes que más sufren la insuficiencia respiratoria y neumonías son los individuos por encima de los 70 años.
Habida cuenta de la importancia que tiene el control del proceso inflamatorio en la lucha terapéutica contra el virus se tienen que desarrollar agentes en distintos escenarios y que deben entenderse como complementarios:
1.- Antivirales potentes y específicos para cada tipo de virus.
2.- Fármacos que promuevan la defensa intrínseca innata antiviral como los interferones.
3.- Moléculas antiinflamatorias que puedan reducir el reclutamiento de células que acaben dañando el tejido pulmonar. Aunque tratándose de enfermedades producidas por agentes infecciosos, esta estrategia es un arma de doble filo pues al reducir la capacidad inflamatoria provocamos inmunosupresión y esto puede ayudar al virus a multiplicarse. Uno de estos ejemplos son los derivados de las cloroquinas, que se utilizan tanto para el tratamiento de enfermedades parasitarias como en enfermedades autoinmunes como la artritis o el lupus y ahora con una interesante efectividad en casos de Covid-19.
4.- Pero podemos ir más allá, siendo más específicos contra las citocinas proinflamatorias con agentes que bloquean el TNF o anticuerpos contra IL-6 o sus receptores. De hecho, en el tratamiento de los casos graves en la epidemia Covid-16 se está administrando de forma muy efectiva tocilizumab, que es un anticuerpos anti-IL-6R y que bloque la actividad biológica de esta IL-6.

Estudio de tocilizumab en pacientes con SARS-Cov-2 por el Servicio de Inmunología del Hospital Ramón y Cajal de Madrid
5.- Otras terapias inmunorreguladoras sobre el receptor de esfingosina-1-fosfato-1 (S1P1R), que suprime el reclutamiento de linfocitos y la producción de citoquinas y quimiocinas, y mejoría la supervivencia sin alterar el aclaramiento viral.
Consideraciones finales
En la defensa inmunitaria contra microorganismos patogénicos es muy importante el equilibrio entre señales y respuestas inflamatorias y antiinflamatorias. De esta forma se consigue erradicar el agente invasor destruyendo la mínima cantidad posible de nuestros propios tejidos. Algunos microorganismos como influenzavirus A y SARS-Cov-2 provocan demasiada respuesta inflamatoria que conduce al deterioro de nuestra protección epitelial del tejido pulmonar con dos implicaciones, por un lado la posibilidad de infecciones oportunistas y por otro lado la insuficiencia respiratoria. En el tratamiento de estas infecciones es tan importante el tratamiento antiviral como el de control de la inflamación junto con otras medidas de soporte para evitar esas infecciones oportunistas. Habida cuenta del resultado tan esperanzador que están teniendo los inmunomoduladores como tocilizumab, el papel de los inmunólogos en la pandemia Covid-19 debe ser tenido en cuenta tanto en el ámbito hospititalario como por nuestros gestores sanitario. En estos momentos, se hace más necesario que nunca el lema del anterior presidente de la Sociedad Española de Inmunología, el Profesor José Ramón Regueiro, «Pongan un inmunólogo en sus vidas».
Referencias
– Liu, Q., Zhou, Y. H., & Yang, Z. Q. (2016). The cytokine storm of severe influenza and development of immunomodulatory therapy. Cellular and Molecular Immunology, 13(1), 3–10. https://doi.org/10.1038/cmi.2015.74
– Chan, M. C. W., Cheung, C. Y., Chui, W. H., Tsao, G. S. W., Nicholls, J. M., Chan, Y. O., Chan, R. W. Y., Long, H. T., Poon, L. L. M., Guan, Y., & Peiris, J. S. M. (2005). Proinflammatory cytokine responses induced by influenza A (H5N1) viruses in primary human alveolar and bronchial epithelial cells. Respiratory Research, 6, 1–13. https://doi.org/10.1186/1465-9921-6-135
– Fiore-Gartland, A., Panoskaltsis-Mortari, A., Agan, A. A., Mistry, A. J., Thomas, P. G., Matthay, M. A., Hertz, T., & Randolph, A. G. (2017). Cytokine profiles of severe influenza virus-related complications in children. Frontiers in Immunology, 8(NOV), 1–12. https://doi.org/10.3389/fimmu.2017.01423
– Brydon, E. W. A., Morris, S. J., & Sweet, C. (2005). Role of apoptosis and cytokines in influenza virus morbidity. FEMS Microbiology Reviews, 29(4), 837–850. https://doi.org/10.1016/j.femsre.2004.12.003
– Zhao, C., Qi, X., Ding, M., Sun, X., Zhou, Z., Zhang, S., Zen, K., & Li, X. (2016). Pro-inflammatory cytokine dysregulation is associated with novel avian influenza a (H7N9) virus in primary human macrophages. Journal of General Virology, 97(2), 299–305. https://doi.org/10.1099/jgv.0.000357
– Teijaro, J. R., Walsh, K. B., Cahalan, S., Fremgen, D. M., Roberts, E., Scott, F., Martinborough, E., Peach, R., Oldstone, M. B. A., & Rosen, H. (2011). Endothelial cells are central orchestrators of cytokine amplification during influenza virus infection. Cell, 146(6), 980–991. https://doi.org/10.1016/j.cell.2011.08.015
– Cheng, V. C. C., Lau, S. K. P., Woo, P. C. Y., & Kwok, Y. Y. (2007). Severe acute respiratory syndrome coronavirus as an agent of emerging and reemerging infection. Clinical Microbiology Reviews, 20(4), 660–694. https://doi.org/10.1128/CMR.00023-07
– Channappanavar, R., & Perlman, S. (2017). Pathogenic human coronavirus infections: causes and consequences of cytokine storm and immunopathology. Seminars in Immunopathology, 39(5), 529–539. https://doi.org/10.1007/s00281-017-0629-x
– Mehta, P., Mcauley, D. F., Brown, M., Sanchez, E., Tattersall, R. S., Manson, J. J., Across, H. L. H., & Collaboration, S. (2020). Correspondence COVID-19 : consider cytokine storm syndromes and. The Lancet, 6736(20), 19–20. https://doi.org/10.1016/S0140-6736(20)30628-0
– Yu, X., Zhang, X., Zhao, B., Wang, J., Zhu, Z., Teng, Z., Shao, J., Shen, J., Gao, Y., Yuan, Z., & Wu, F. (2011). Intensive cytokine induction in pandemic H1N1 influenza virus infection accompanied by robust production of IL-10 and IL-6. PLoS ONE, 6(12), 1–9. https://doi.org/10.1371/journal.pone.0028680
– Van Reeth, K. (2000). Cytokines in the pathogenesis of influenza. Veterinary Microbiology, 74(1–2), 109–116. https://doi.org/10.1016/S0378-1135(00)00171-1
– Sládková, T., & Kostolanský, F. (2006). The role of cytokines in the immune response to influenza A virus infection. Acta Virologica, 50(3), 151–162.
– Teijaro, J. R., Walsh, K. B., Rice, S., Rosen, H., & Oldstone, M. B. A. (2014). Mapping the innate signaling cascade essential for cytokine storm during influenza virus infection. Proceedings of the National Academy of Sciences of the United States of America, 111(10), 3799–3804. https://doi.org/10.1073/pnas.1400593111
– Khanna, M., Rajput, R., Kumar, B., Kumari, A., & Saxena, L. (2014). Influenza virus Induced Cytokine Responses: An Evaluation of Host-Pathogen Association. Immunome Research, 01(s2), 15–18. https://doi.org/10.4172/1745-7580.s2.001
