La pandemia
 Tras 10 meses con nosotros, las cifras globales de la pandemia COVID-19 asustan. En sus seis primeros meses se detectaron 10 millones de casos, pero en los últimos tres meses se han infectado 30 millones de sujetos. Y ya han muerto más de un millón de personas. Actualmente cada 3 días hay un nuevo millón de infectados. Afortunadamente si bien el número de infectados se ha triplicado en la mitad de tiempo de pandemia, el de muertos “sólo” se ha duplicado. Ante tal magnitud de COVID-19, a escala global y como nunca ante se había visto, los gobiernos y la industria farmacéutica se apresuran a encontrar una manera de frenar esta terrible enfermedad infecciosa que ha puesto en jaque el mundo en que vivimos.
Tras 10 meses con nosotros, las cifras globales de la pandemia COVID-19 asustan. En sus seis primeros meses se detectaron 10 millones de casos, pero en los últimos tres meses se han infectado 30 millones de sujetos. Y ya han muerto más de un millón de personas. Actualmente cada 3 días hay un nuevo millón de infectados. Afortunadamente si bien el número de infectados se ha triplicado en la mitad de tiempo de pandemia, el de muertos “sólo” se ha duplicado. Ante tal magnitud de COVID-19, a escala global y como nunca ante se había visto, los gobiernos y la industria farmacéutica se apresuran a encontrar una manera de frenar esta terrible enfermedad infecciosa que ha puesto en jaque el mundo en que vivimos.
El desarrollo de una vacuna segura y protectora contra el coronavirus SARS-CoV-2 comenzó en muchos laboratorios a la vez y tan pronto como se pudo, gracias a la secuenciación del genoma del virus. En estos momentos se están trabajando en más de 150 vacunas contra el coronavirus en todo el mundo con la esperanza de llevar al menos una al mercado en un tiempo récord para aliviar la crisis mundial. La Organización Mundial de la Salud supervisa a las 42 que están más evolucionadas y también está coordinando los esfuerzos globales para desarrollar una vacuna, con miras a administrar dos mil millones de dosis para fines de 2021. Las empresas biotecnológicas con más experiencia en el ámbito, en pocas semanas ya habían puesto a prueba sus hipótesis y a principios de abril ya habían fabricado cientos de dosis, listas para su uso en ensayos clínicos. En menos de tres meses ya teníamos resultados de las fasesI y II de estos ensayos en miles de voluntarios sanos, demostrando en muchos casos que las vacunas eranseguras para su uso. Estos ensayos en fases tempranas también demostraron que la vacunación provocaba justamente el tipo de respuesta inmune al COVID-19 que esperábamos lograr, producción de anticuerpos y células citotóxicas contra el virus.
De todos los intentos de generar vacunas sólo 8 modelos experimentales con administración intramuscular ya han entrado en fase III de evaluación, con el objetivo de reclutar entre 10.000 y 60.000 sujetos en cada uno de ellos. Aunque en los ensayos en fase III un par de vacunas han tenido que pararse momentáneamente por algún efecto adverso. La del Jenner Institute en Oxford se detuvo por un problema neurológico, pero continuando su camino poco después (excepto en USA). La de Johnson & Johnson a fecha de hoy aún sigue parada por un efecto adverso en un voluntario. Con el desarrollo de estas vacunas tenemos otro detalle importante y nuca visto hasta la fecha, la necesidad es tan imperiosa que algunos laboratorios de forma altruista han descartado obtener beneficios comerciales de la vacuna y con su venta solo pretenden cubrir los costes de desarrollo y fabricación.
Las vacunas
Si todo sale según lo planeado y cada vacuna cumple con todos los estándares regulatorios necesarios, se fabricarán a una escala nunca vista antes y también deberán estar disponibles para su uso en países coningresos bajos. Algunas de estas compañías, como AstraZeneca, ya se han comprometido a producir dos mil millones de dosis, cada una con un costo de alrededor de 4 €. Los candidatos a inmunizar contra COVID-19, como todas las vacunas, tienen como objetivo fundamental instruir al sistema inmunológico para que monte una defensa, lo más similar posible a la que se conseguiría a través de una infección natural y con menos consecuencias para la salud. Para hacerlo, algunas vacunas usan todo el coronavirus, pero en un estado muerto o debilitado. Otras usan solo una parte del virus, ya sea una proteína o un fragmento. Algunas transfieren las proteínas del coronavirus a un virus diferente, como un adenovirus de chimpancé, que es poco probable que cause una enfermedad en humanos. Finalmente, algunas vacunas en desarrollo se basan en el despliegue de partes del material genético del coronavirus, por lo que nuestras células pueden producir temporalmente las proteínas del coronavirus necesarias para estimular nuestro sistema inmunológico. El gen o proteína elegida en todos los diseños actuales es la glicoproteína de superficie spike.
 Normalmente y debido al proceso de desarrollo, regulación, producción y distribución, puede llevar de 10 a 15 años lanzar una vacuna al mercado; sin duda un proceso largo en sí mismo, pero seguro y eficaz. Con la COVID-19 se están rompiendo todas estas limitaciones espaciotemporales y pretendemos tener una vacuna de uso en un año o menos. Pese a esta reducción tan drástica inaudita, las empresas farmacéuticas insisten en que se están llevando a cabo todos los procedimientos reglamentarios que garantizarán su seguridad y eficacia. Todo el proceso comprimido, hasta el punto de que las Agencias están permitiendo que finalicen los ensayos antes de tiempo si sus resultados provisionales son abrumadoramente positivos o negativos. Por otro lado, tenemos las presiones políticas que están empujando al límite todo este proceso para poder tener rédito electoral. Aunque es demasiado pronto para decir qué candidatos tendrán éxito en última instancia, los países se hayan ante la tesitura de apostar por alguna de ellas y adelantar pedidos de decenas de millones de dosis. El desarrollo ha sido tan vertiginoso porque algunas compañías biotecnológicas como la de Oxford tenían ya experiencia en generar vacunas contra otros coronavirus, en concreto MERS, y eso les daba cierta ventaja. En el caso de Oxford en pocas semanas ya habían generado el vector y en febrero ya habían producido suficientes como para evaluar su papel in vitro y en animales de experimentación. Aparentemente el desafío no está en generar el inmunógeno, el limitante será su seguridad, eficacia y su escalabilidad a la hora de fabricarlos a gran escala.
Normalmente y debido al proceso de desarrollo, regulación, producción y distribución, puede llevar de 10 a 15 años lanzar una vacuna al mercado; sin duda un proceso largo en sí mismo, pero seguro y eficaz. Con la COVID-19 se están rompiendo todas estas limitaciones espaciotemporales y pretendemos tener una vacuna de uso en un año o menos. Pese a esta reducción tan drástica inaudita, las empresas farmacéuticas insisten en que se están llevando a cabo todos los procedimientos reglamentarios que garantizarán su seguridad y eficacia. Todo el proceso comprimido, hasta el punto de que las Agencias están permitiendo que finalicen los ensayos antes de tiempo si sus resultados provisionales son abrumadoramente positivos o negativos. Por otro lado, tenemos las presiones políticas que están empujando al límite todo este proceso para poder tener rédito electoral. Aunque es demasiado pronto para decir qué candidatos tendrán éxito en última instancia, los países se hayan ante la tesitura de apostar por alguna de ellas y adelantar pedidos de decenas de millones de dosis. El desarrollo ha sido tan vertiginoso porque algunas compañías biotecnológicas como la de Oxford tenían ya experiencia en generar vacunas contra otros coronavirus, en concreto MERS, y eso les daba cierta ventaja. En el caso de Oxford en pocas semanas ya habían generado el vector y en febrero ya habían producido suficientes como para evaluar su papel in vitro y en animales de experimentación. Aparentemente el desafío no está en generar el inmunógeno, el limitante será su seguridad, eficacia y su escalabilidad a la hora de fabricarlos a gran escala.
Pero el desarrollo de las vacunas se enfrenta a un nuevo reto, la variabilidad adaptativa del virus. La mutación D614G y que afecta a la proteína spike es una de las predominantes en estos momentos en los coronavirus que nos acechan y nos tenemos que preguntar si esta mutación ha aumentado la tasa de infectividad y si esta va a modificar la eficacia de las vacunas en desarrollo. En estudios in vitro en cultivos de epitelio nasal humano, la variante G se replica con mucha mayor eficacia y rapidez, en un orden de 10 veces, que la variable ancestral D. En estudios donde se hace competir ambas variantes del virus, tras cuatro pases ya no se observan variantes D y los cultivos están totalmente dominados por la cepa contemporánea. También se ha analizado su comportamiento en hámsteres que portan el receptor ACE2 humano y se ha visto como se aumentaba su infectividad mediante aerosoles frente a la variante D, lo que justifica aún más su alta tasa de sustitución de una variante por otra. Pero hay un dato esperanzador, aunque está en la parte externa de spike, no corresponde a un aminoácido fundamental en su interacción con el receptor y los anticuerpos generados a partir de una infección natural con virus que contienen D614 neutralizan de forma cruzada a la variante G614, lo que sugiere que el locus no es crítico para la inmunidad mediada por anticuerpos.
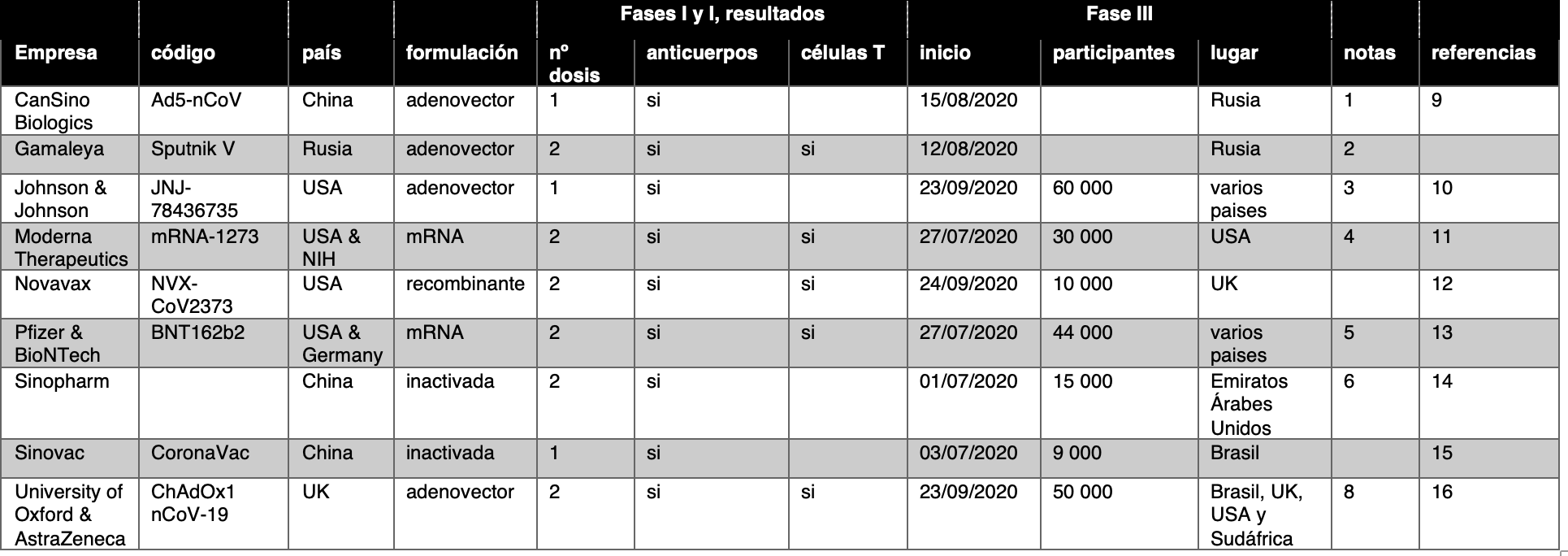
Tabla 1. para ver las notas y referencias de cada ensayo ve al final del documento
¿Protección ante la enfermedad o protección ante la transmisión?
Si bien se están desarrollando vacunas contra COVID -19 a una velocidad sin precedentes, ninguna de ellas se ha desarrollado y probado para ver si realmente pueden detener o contener la transmisión del virus. Los ensayos están diseñados para evitar que quienes están vacunados desarrollen la enfermedad COVID-19, pero no para que no se infecten. Por consiguiente, si bien las personas vacunadas pueden estar protegidas, también podrían propagar el virus. Mitigar la sintomatología no es prevenir la diseminación de la infección. Y este detalle es fundamental si estamos como desesperados buscando esa inmunidad de grupo que pueda detener la alta tasa de infectividad que SARS-CoV-2 ha manifestado. Por lo tanto, podemos encontrarnos en la paradoja que las personas no sufran la enfermedad, pero sean magníficos entes infecciosos de la misma. Lo que se está evaluando en estos ensayos a las vacunas es realmente el poder protector ante la sintomatología de la enfermedad pues a los voluntarios que participan en los ensayos clínicos sólo se les pide que reporten si manifiestan síntomas, y es en ese momento cuando se les analiza la presencia del virus en sus tejidos. Pero si los individuos son asintomáticos pasaran inadvertidos para los científicos que supervisan los ensayos. Para no perder esta población de asintomáticos y potencialmente contagiadores se deberían hacen test masivos a todos los sujetos participantes en estudio con una periodicidad semanal. En ensayos con más de 60.000 participantes ello parece inabordable, a pesar de que sería lo recomendable.
 De hecho, tenemos evidencias experimentales en primates no humanos que las vacunas pueden prevenir los síntomas y no frenar la diseminación de la infección. Lo que se ha observado es que, en monos vacunados y sometidos a infección, los pulmones están muy limpios de virus y los monos libres de síntomas, mientras que en la cavidad nasofaríngea persisten los virus con carácter infectivo. No pensemos que ante esta contrariedad las vacunas son ineficaces, pues cumplen un papel muy satisfactorio evitando la enfermedad en infectados, pero no reduciendo al nivel que esperamos la infectividad de los sujetos y la capacidad de la tan esperada inmunidad de grupo para proteger de forma masiva a la población mundial. Y ahí juega un papel crucial el ya famoso índice R (el número básico de reproducción), y que tenemos que tener en cuenta que aún esta por determinar con precisión pues hay gran variabilidad entre regiones. Recordemos que el número R es una forma de cuantificar la capacidad de propagación de cualquier enfermedad, incluida la del SARS-CoV-2. En definitiva, R es la cantidad de personas a las que una persona infectada transmitirá un virus. El sarampión tiene uno de los números más altos con un número R de 15 en poblaciones sin inmunidad; eso significa que, en promedio, una persona transmitirá el sarampión a otras 15.El coronavirus tiene un número R entre tres y cuatro si no tomamos medidas para detener su propagación.En los países europeos llegó ser de cuatro y actualmente ronda el valor de 1. Como tenemos que pensar de forma global y tener en cuenta la gran dispersión de infecciones, posiblemente alrededor del 25-50% de la población tendría que ser inmune al virus para lograr la supresión de la transmisión comunitaria o la inmunidad de grupo.
De hecho, tenemos evidencias experimentales en primates no humanos que las vacunas pueden prevenir los síntomas y no frenar la diseminación de la infección. Lo que se ha observado es que, en monos vacunados y sometidos a infección, los pulmones están muy limpios de virus y los monos libres de síntomas, mientras que en la cavidad nasofaríngea persisten los virus con carácter infectivo. No pensemos que ante esta contrariedad las vacunas son ineficaces, pues cumplen un papel muy satisfactorio evitando la enfermedad en infectados, pero no reduciendo al nivel que esperamos la infectividad de los sujetos y la capacidad de la tan esperada inmunidad de grupo para proteger de forma masiva a la población mundial. Y ahí juega un papel crucial el ya famoso índice R (el número básico de reproducción), y que tenemos que tener en cuenta que aún esta por determinar con precisión pues hay gran variabilidad entre regiones. Recordemos que el número R es una forma de cuantificar la capacidad de propagación de cualquier enfermedad, incluida la del SARS-CoV-2. En definitiva, R es la cantidad de personas a las que una persona infectada transmitirá un virus. El sarampión tiene uno de los números más altos con un número R de 15 en poblaciones sin inmunidad; eso significa que, en promedio, una persona transmitirá el sarampión a otras 15.El coronavirus tiene un número R entre tres y cuatro si no tomamos medidas para detener su propagación.En los países europeos llegó ser de cuatro y actualmente ronda el valor de 1. Como tenemos que pensar de forma global y tener en cuenta la gran dispersión de infecciones, posiblemente alrededor del 25-50% de la población tendría que ser inmune al virus para lograr la supresión de la transmisión comunitaria o la inmunidad de grupo.
Todo ello nos tiene que hacer replantearnos qué es lo que vamos a poder conseguir y que las autoridades sanitarias lo tengan presente e introduzcan esas variables en su pronóstico sobre el curso de la pandemia. A la vista de ello el retorno a la normalidad una vez estén disponibles las vacunas puede que sea más costoso y difícil de lo que hubiéramos esperado.
Además, y redundando en la eficacia de las medidas vacunales tenemos ejemplo día a día de que estas están en un rango y no son absolutas. Por ejemplo, la viruela y la polio han podido ser erradicadas del planeta mientras que la vacuna de la gripe tiene una eficacia muy limitada como inmunidad de grupo y año a año. En el caso del coronavirus estas diferencias aún podrán ser más marcadas si tenemos en cuenta que hay varias estrategias para generar el inmunógeno (atenuados, subunidades, RNA y vectores virales), todas compitiendo apresuradamente y si demuestran esa eficacia en las fases III estarán de forma sincrónica todas en el mercado. Eso si con el fin de asegurarse un stock para sus ciudadanos los países han confiado empíricamente en el desarrollo de ciertas compañías y ya han hecho sus pedidos.
Nos enfrentamos a un virus respiratorio y sabemos sobradamente que la administración intranasal de la vacuna simula mucho mejor lo que sucede realmente en la infección. Esta ruta produce mucha más inmunidad en la mucosa de las vías aéreas superiores que la inyección intramuscular del inmunógeno. Ninguna de las vacunas que van más avanzadas en su desarrollo han elegido esta vía, todas son intramusculares. Esta vía va a generar muchos anticuerpos en la sangre y en tejidos muy vascularizados como el pulmón, pero mucho menos en otros tejidos como es el caso de la ya citada mucosa oronasofaríngea.
Y tenemos también claros ejemplos de como se comportan dos tipos de vacunas ante un mismo microorganismo según se administren de una forma u otra. Me estoy refiriendo a la vacuna de la poliomielitis. La primera que se desarrolló era la vacuna de Salk y consistía en virus “vivos” atenuados que se administraban de forma oral. Sabin desarrolló posteriormente la vacuna de virus “muertos” inactivados que se administraba por inyección intramuscular. La vacuna de Sabin protegía muy bien ante los nocivos efectos de la enfermedad, pero en absoluto detenía la infección de los sujetos vacunados y esos podían seguir diseminando los virus por vía intestinal. Por contra la vacuna de Salk generaba una inmunidad potente en el aparato digestivo neutralizando mucho más efectivamente la posible infectividad de los virus y por consiguiente evitando la enfermedad de los sujetos.

Cuanto durará la inmunidad
Ante esta cuestión nos tenemos que plantear dos posibles escenarios. Uno de ellos es la duración de los anticuerpos neutralizantes y los linfocitos T de memoria contra el coronavirus. La otra es la posible variabilidad antigénica de SARS-CoV-2 con el tiempo y que haga que esta inmunidad sea insuficiente, como sucede año tras año para la gripe. Para la primera cuestión no tenemos ninguna pista o evidencia que nos haga presuponer algo. Ni siquiera lo que sucede in vivo en los infectados. La humanidad llevamos menos de un año enfrentándonos a esta pandemia y hemos cuantificado robustas tasas de anticuerpos en los que han pasado la infección, pero no sabemos aún cuanto puede durar la inmunidad en los individuos que se han recuperado de la enfermedad. Y tengamos presente que este es el escenario más apropiado para generar una potente y protectora inmunidad. Algo que queremos emular con los diseños de nuestras vacunas pero que somos conscientes que jamás se conseguirán tasas de inmunidad como el contacto natural con el microorganismo.
Además, estudiando este aspecto tenemos un sesgo experimental muy importante pues tendemos, por ser más fácil y asequible, a analizar los anticuerpos contra coronavirus, si es posible neutralizantes. Pero analizamos menos, y con mucha más dificultad, la presencia de linfocitos T que van a participar en la memoria inmunológica tanto de tipo helper como citotóxico. Tenemos que ser conscientes que una bajada en el título de anticuerpos neutralizantes anti-SARS-Cov-2 no tiene porqué significar una falta de protección.
Y del papel que juegan las células en el control de las enfermedades virales tenemos amplia experiencia y evidencia. Sabemos que sujetos con inmunodeficiencias de anticuerpos responden muy bien ante vacunaciones virales y adquieren inmunidad efectiva. Con la excepción de coxackie y poliovirus, para el resto de virus, sólo las células T son capaces de controlar las infecciones. Además, las evidencias que arrojaron las pasadas epidemias de coronavirus como SARS y MERS mostraron que los anticuerpos neutralizantes en sujetos que habían pasado la infección se podían observar tras dos o tres años, pero lo más esperanzador es que a día de hoy aún se pueden identificar en ellos células T de memoria. Eso sí, tengamos presente que es inmunidad ganada ante la infección activa y no generada artificialmente mediante vacunas, un detalle importante.
Pero ante la segunda incógnita de la variabilidad del coronavirus, el conocimiento que tenemos del tropismo y la biología del virus sí que nos puede permitir aventurarnos a elucubrar y lanzar hipótesis. Los coronavirus no han mostrado deriva genética como sí que lo han hecho los virus de la influenza, lo que es muy importante para mantener la eficacia. Y, por otro lado, sabemos que el tropismo y la capacidad de interacción de la proteína spike con el receptor ACE2 humano es tan fundamental que deja poca cabida a variación o mutación que no lleven aparejados virus que sean mucho menos infectivos y patogénicos.
No tenemos constancia de que los coronavirus sufran recombinación (reassortment) como lo hacen los virus de genomas segmentados como influenza virus, reovirus y bunyavirus.
Pero nos queda un tercer reto a la hora de analizar la inmunidad ganada por los infectados o los vacunados. Hasta el momento la prevalencia y la duración de las respuestas de anticuerpos neutralizantes después de la infección se están realizando mediante la neutralización de pseudotipos o ensayos de ELISA no funcionales. Será vital que en un futuro se puedan definir mediante ensayos de neutralización de referencia que utilizan virus vivos en lugar de estos ensayos de aproximación más asequibles y menos precisos.
Y voy a terminar este ensayo haciendo una consideración final sobre las vacunas y que no es menos importante que las expuestas hasta ahora. Me estoy refiriendo a la estrategia de asignación de la vacuna COVID-19. Después de que se apruebe alguna vacuna y esté disponible, las autoridades sanitarias deberán decidir qué poblaciones han de recibirla primero y a qué costo. Parece ser que se asignarían preferentemente las vacunas a personas con alto riesgo de morbilidad y mortalidad graves. Otros dos criterios adicionales para la asignación equitativa de vacunas serán los riesgos de contraer la infección y de generar un impacto social negativo. Por ello, los trabajadores de primera línea de atención médica y otros trabajos esenciales, como los maestros de escuela, pertenecen a estos grupos. En el primer grupo, lo sujetos de edad avanzada están en esos colectivos y sabemos que, aunque en ellos hay que prevenir enfermedades infecciosas para no agravar su deterioro fisiológico con la edad, las vacunas son menos efectivas en poblaciones de mayor edad que en poblaciones más jóvenes, en parte debido a la senescencia inmunológica. Y esto lo vemos temporada a temporada con la vacunación anual de la gripe. Por consiguiente, es probable que los datos de eficacia puedan quedar en parte eclipsados por el “primer grupo experimental” al que se va a enfrentar en sus comienzos la vacuna.
En definitiva, a pesar de estas consideraciones, las vacunas COVID-19 son necesarias, incluso si tienen un impacto mínimo en la transmisión y a pesar de los desafíos de la asignación de vacunas. Lo que es probable que logren estas vacunas podría no ser el final de la COVID-19 pero sí que darán un paso de gigante en la erradicación de esta pandemia.

Notas y Referencias
1. Aún estando técnicamente en la fase dos de su ensayo, el 25 de junio CanSino se convirtió en la primera empresa en recibir una aprobación limitada para usar su vacuna en personas. El gobierno chino ha aprobado la vacuna solo para uso militar, por un período de un año.
2. A pesar de la falta de evidencia publicada, Rusia aprobó la vacuna Sputnik V para un uso generalizado y la reclamó como la primera vacuna COVID-19 registrada en el mercado. La Organización Mundial de la Salud, sin embargo, enumera la vacuna Sputnik V como en la fase uno de los ensayos clínicos
3. El ensayo ENSEMBLE incluirá una “representación significativa” de las poblaciones de mayor edad y aquellas con afecciones subyacentes que las hacen más susceptibles a COVID-19. El 12 de octubre, Johnson & Johnson anunció que había detenido estos ensayos para una revisión de seguridad independiente debido a una enfermedad inexplicable en un participante.
4. Esta tecnología nunca ha sido autorizada para ninguna enfermedad. Si tiene éxito, sería la primera vacuna de ARNm aprobada para uso humano. Moderna dice que está en camino de administrar al menos 500 millones de dosis por año a partir de 2021 (fabricante suizo Lonza)
5. Pfizer ha firmado un contrato de casi 2 mil millones de $ con el gobierno de USA para proporcionar 100 millones de dosis para diciembre de 2020. Espera suministrar 1.300 millones de dosis para fines de 2021
6. Esperan llegar al público a finales de 2020. Cientos de miles de civiles chinos ya han sido vacunados con la aprobación de uso de emergencia del gobierno. La compañía seleccionó a los Emiratos porque tiene una población diversa compuesta por aproximadamente 200 nacionalidades, lo que lo convierte en un campo de pruebas ideal.
7. Se ha comprometido a producir mil millones de dosis de vacunas que acordaron vender al costo. El 8 de septiembre, AstraZeneca detuvo los ensayos para una revisión de seguridad debido a una reacción adversa en un participante en el Reino Unido.Los ensayos se reanudaron en el Reino Unido, Brasil, Sudáfrica e India, pero permanecieron en espera en USA.
8. Zhu, F. C. et al. Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo-controlled, phase 2 trial. Lancet 396, 479–488 (2020). https://doi.org/10.1016/S0140-6736(20)31605-6
9. Mercado, N. B. et al. Single-shot Ad26 vaccine protects against SARS-CoV-2 in rhesus macaques. Nature 586, 583-588 (2020) https://doi.org/10.1038/s41586-020-2607-z
10. Corbett, K. S. et al. Evaluation of the mRNA-1273 Vaccine against SARS-CoV-2 in Nonhuman Primates. N. Engl. J. Med. (2020) https://doi.org/10.1056/nejmoa2024671
11. Keech, C. et al. Phase 1–2 Trial of a SARS-CoV-2 Recombinant Spike Protein Nanoparticle Vaccine. N. Engl. J. Med. (2020) https://doi.org/10.1056/nejmoa2026920
12. Walsh, E. E. et al. Safety and Immunogenicity of Two RNA-Based Covid-19 Vaccine Candidates. N. Engl. J. Med. (2020) https://doi.org/10.1056/NEJMoa2027906
13. Xia, S. et al. Effect of an Inactivated Vaccine Against SARS-CoV-2 on Safety and Immunogenicity Outcomes: Interim Analysis of 2 Randomized Clinical Trials. J. Am. Med. Assoc. 324, 951–960 (2020). https://doi.org/10.1001/jama.2020.15543
14. Gao, Q. et al. Development of an inactivated vaccine candidate for SARS-CoV-2. Science 369, 77–81 (2020). https://doi.org/10.1126/science.abc1932
15. Folegatti, P. M. et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. Lancet 396, 467–478 (2020). https://doi.org/10.1016/S0140-6736(20)31604-4
16. Peiris, M. & Leung, G. M. What can we expect from first-generation COVID-19 vaccines? Lancet (2020) https://doi.org/10.1016/s0140-6736(20)31976-0
17. van Doremalen, N. et al. ChAdOx1 nCoV-19 vaccine prevents SARS-CoV-2 pneumonia in rhesus macaques. Nature 586, 578–582 (2020) https://doi.org/10.1038/s41586-020-2608-y

