1.- Introducción
La vacunación es el mejor método para la prevención y el control de enfermedades infecciosas. El desarrollo de muchas vacunas ha salvado miles de vidas y ha ahorrado grandes cantidades de dinero a los sistemas de salud y como estamos viendo en el caso de COVID-19, el impacto sobre la salud y la economía global será brutal. Los inmunólogos junto con los epidemiólogos somos los profesionales que debemos conocer el mecanismo de acción que genere de forma segura inmunidad y analizar el impacto de las vacunas en la sociedad.
Conseguir una vacuna eficaz y rápida ante una pandemia por un virus emergente requiere dos puntos cruciales:
- En primer lugar, precisión y efectividad en el diseño de antígeno viral.
- Y en segundo lugar una plataforma de fabricación que sea capaz de acortar el tiempo de disponibilidad del producto en el mercado.
Las vacunas basadas en subunidades de proteínas y producidas en líneas celulares suelen tardar más de un año en generarse. Por el contrario, la fabricación de vacunas de ácido nucleico (ADN y ARN mensajero, ARNm) se pueden lograr en cuestión de semanas. Por eso, y poco menos de un año desde que se desatase la pandemia zoonótica, seis países, Reino Unido, Canadá, Arabia Saudita, Bahréin, EE. UU. y México ya han dado su aprobación a la vacuna de Pfizer-BioNTech. Y se espera un curso similar para la vacuna de Moderna en los próximos días. Dos vacunas de ARNm.
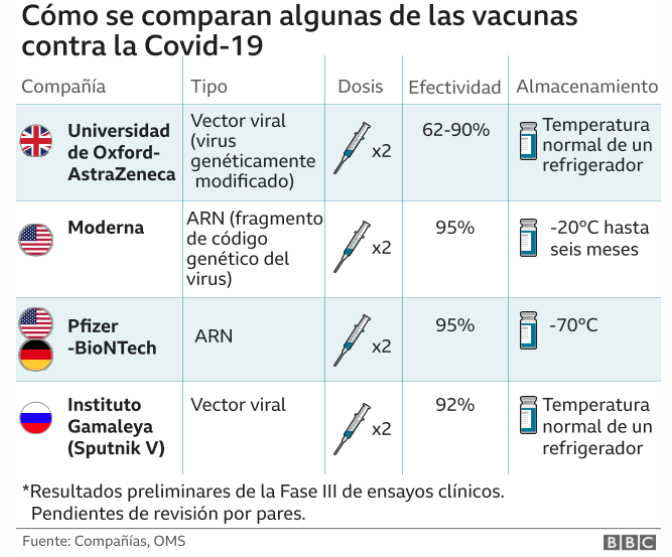
La aprobación de una vacuna de ARNm para el coronavirus significa, por un lado, la autorización de la primera de su tipo contra enfermedades infecciosas. Y por otro lado una revolución en el concepto que teníamos hasta ahora de diseñar y elaborar vacunas. Estas, hasta la fecha actuaban inyectando el patógeno o parte de él para que pudiera entrenar al sistema inmunitario para reconocerlo y responder a las proteínas producidas por el mismo microorganismo. Pero, por el contrario, las vacunas de ARNm usan al propio organismo para producir de forma segura algunas de las proteínas virales para inducir esa respuesta inmunitaria contra el patógeno.
Si nos centramos el agenta causal de la COVID-19, la proteína S del SARS-CoV-2 es un polipéptido transmembranario de tipo I con un ectodominio grande y un endodominio corto. Estructuralmente esta proteína S está compuesta por dos subunidades funcionales, S1 (bulb) para unión al receptor y S2 (stalk) para la fusión de membranas. La interacción específica entre S1 y el receptor desencadena un cambio conformacional en la subunidad S2, lo que lleva a la fusión entre la envoltura del virus y la membrana de la célula y la posterior liberación de la nucleocápside en el citoplasma. El SARS-CoV-2 utiliza al receptor de la enzima convertidora de angiotensina 2 (ACE2) como su receptor de entrada. Por ello esa proteína S o el dominio de unión al receptor es el principal objetivo de los anticuerpos neutralizantes y puede ser el principal antígeno de desarrollo de las vacunas del SARS-CoV-2.
2.- Las nuevas vacunas de ADN y ARN
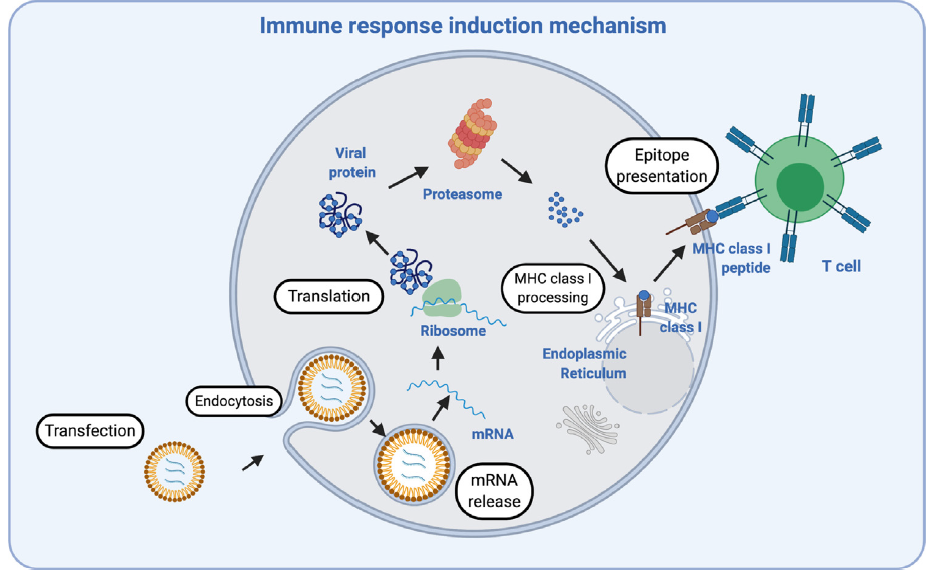
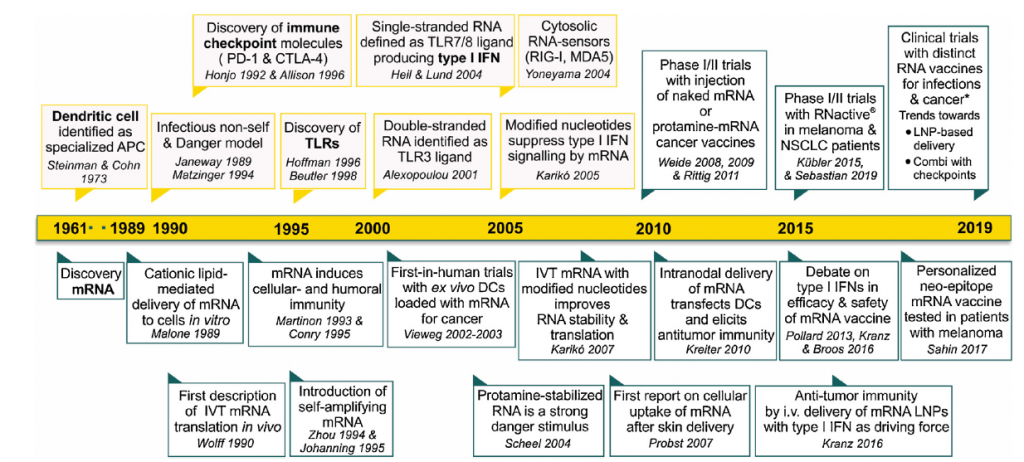
Aunque las vacunas de ácidos nucleicos surgieron hace casi 30 años poco conocíamos de ellas hasta el surgimiento de la pandemia por beta-coronavirus y apuntan a ser uno de los grandes éxitos en la vacunación mundial. Los primeros abordajes se realizaron usando ADN desnudo en forma de plásmidos o asociado a nanopartículas de oro. Estas vacunas de ADN consisten en genes que codifican antígenos insertados en un plásmido bacteriano bajo el control de un promotor eucariota. El plásmido es internalizado por las células del hospedador, donde se transcribe en el núcleo y es traducido en el citoplasma por la maquinaria de la célula. Las proteínas resultantes se procesan en péptidos, que finalmente se presentan en la superficie de las células presentadoras de antígeno (APC) en el contexto del complejo principal de histocompatibilidad (MHC).
Alternativamente, las vacunas de ARN involucran ARN mensajero (ARNm) sintetizado en el laboratorio por transcripción in vitro (IVT) utilizando polimerasas de bacteriófago sobre un ADN molde que codifica el o los antígenos de interés.
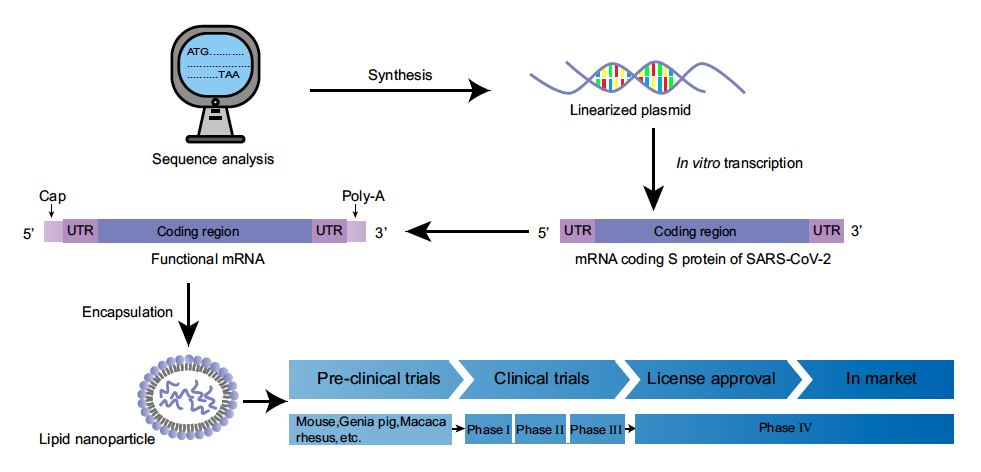
Una vez administrado e internalizado por las células huésped, el ARN se traducen directamente en el citoplasma por la propia célula y luego, como en las vacunas de ADN, los antígenos resultantes son presentado por las APC para estimular una respuesta inmunitaria. Otras ventajas del ARNm frente al ADN es que el ARNm es la cantidad mínima de información genética necesaria para generar la proteína de interés en la célula y que además el ARNm de cadena simple no interacciona con el genoma bicatenario, no produce recombinaciones con el ADN y no hay maquinaria celular para su duplicación intracelular (con algunas excepciones que veremos luego). Además, el ARN no puede integrarse en el genoma y por lo tanto no tiene potencial oncogénico. Así, este ARNm queda patente que es meramente transitorio aumentando su seguridad y eficacia.
A pesar de las características prometedoras de las vacunas de ADN, se ha visto que provocan menos inmunidad que otros tipos de vacunas, incluida las vacunas de ARNm. Una posible explicación sería la necesidad de que el ADN tenga que cruzar dos membranas celulares, la nuclear y la plasmática. A diferencia del ADN, el ARNm solo necesita entrar en el citoplasma, donde se produce la traducción.
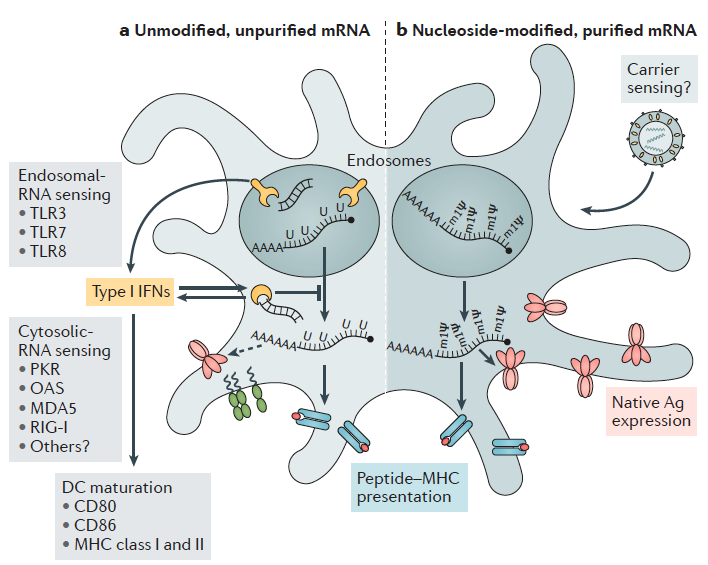
Otro aspecto muy relevante es que el ARN puede actuar como un adyuvante al proporcionar señales coestimuladoras. Sabemos que, para ser eficientes, las vacunas deben contener un potente adyuvante que suministre una señal de peligro para el inicio de la respuesta inmunitaria. Las propiedades inmunoestimuladoras del ARNm fueron descubiertas por la observación de la inducción de interferón tras la exposición de las células a ARNm exógeno extraído de virus. Sin embargo, los efectos secundarios graves de estos adyuvantes pronto limitaron su uso. Más tarde, en el año 2004, se demostró que el ARNm transcrito in vitro sirve como un adyuvante. Los ARN mono y bicatenarios son reconocidos por los receptores tipo toll TLR3, TLR7 y TLR8 en el endosoma. Sin embargo, TLR3 no es sólo activada por ARN bicatenario, un intermediario para muchos virus, sino también por el ARNm liberado de las células o producido por transcripción in vitro. Otros receptores de reconocimiento de patrones pueden ser importantes para la funcionalidad de un adyuvante (y vacuna) basado en ARN. La helicasa citosólica RIG-I reconoce moléculas de ARN simple.
3.- Ventajas de vacunas de ácidos nucleicos
Existen diversas razones que hacen que las vacunas de ácidos nucleicos sean tan interesantes a la hora de vacunar no sólo contra agentes infecciosos sino a antígenos tumorales.
Desde el punto de vista de su producción:
- Los ácidos nucleicos son más simples de generar que las proteínas, péptidos, células o microorganismos atenuados o muertos.
- Su administración parece segura en cualquier colectivo, como, por ejemplo, inmunodeficientes.
- Es la propia maquinaria celular del hospedador la que producirá las proteínas inmunogénicas.
- Las vacunas de ácido nucleico permitirían la administración de varias secuencias que codificaran para múltiples antígenos.
- Al hacer que el cuerpo humano produzca las proteínas virales, las vacunas de ARNm eliminan parte del proceso de fabricación y debería ser más fácil y rápido de producir que las vacunas tradicionales.
Y desde el punto de vista inmunológico:
- Las vacunas basadas en ácidos nucleicos simulan una infección o inmunización con microorganismos vivos, que son las más eficientes a la hora de generar inmunidad.
- A diferencia de otras formas más complejas de administrar ácidos nucleicos como las encapsuladas en vectores virales, no son susceptibles de ser neutralizadas por anticuerpos y que podrían disminuir su eficacia.
- Al ser absolutamente simples y no necesitar recubrimientos proteicos, la respuesta inmune será absolutamente pura contra el potencial inmunógeno sin interferencia con otros posibles epitopos inmunodominantes que pudieran existir en otro tipo de nanopartículas o microorganismos completos.
- Con la de ARNm no estamos introduciendo todo el virus por lo que el microorganismo no puede montar su propia autodefensa y, por lo tanto, el sistema inmunitario puede concentrarse en crear una respuesta a las proteínas virales sin interferencia del virus.
- Contrariamente a lo que sucede con las vacunas de péptidos, las de ARNm no tienen ninguna restricción de haplotipos del HLA a la hora de poder presentar los antígenos.
- En las vacunas clásicas el péptido microbiano solo activa al sistema inmunitario adquirido e inducen tanto inmunidad humoral como celular mientras que el sistema inmunológico innato, necesario para el inicio de la respuesta inmunitaria, es activado inespecíficamente por el adyuvante. Por el contrario, el ARNm de las nuevas vacunas es de por si un PAMP detectable por receptores que reconocen patrones (PRR) y por consiguiente también podría activar el sistema inmunológico innato, pero de forma específica, proporcionando un nivel adicional de defensa sin necesidad de añadir adyuvantes.
4.- Estructura del ARN mensajero
El ARN eucariótico está compuesto por cinco regiones que son críticas no solo para portar la información codificada sino para darle estabilidad y capacidad de lectura.
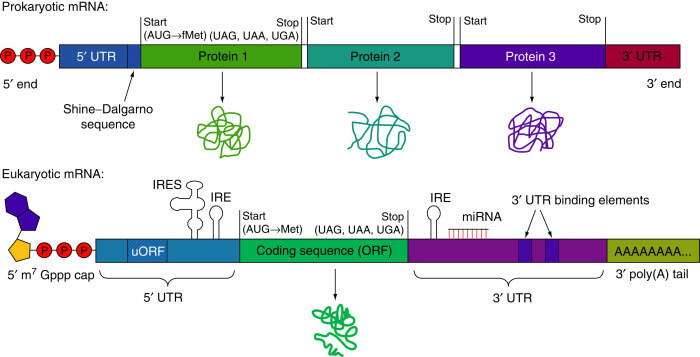
Estas son:
1.- Una región codificante que comienza con AUG (Met) y acaba con tres posibles codones stop (UAG, UAA, UGA). En ella está la información genética para la síntesis de la proteína inmunogénica para la vacunación. El diseño de esta ORF tiene que tener en cuenta el uso de codones por humanos y debido a la degeneración del código genéticos, las especies de ARN de transferencia predominantes, pues sabemos que varían significativamente entre especies.
2.- Dos regiones no traducidas (UTR) que flanquean en 3’ y 5’ la región codificante. Aunque no codifican para proteínas estas regiones tienen importantes elementos reguladores de la traducción. Existen alternativas para mejorar la eficiencia traduccional de un gen como incorporar o sustituir las regiones UTR del gen en cuestión por la de los genes de las alfa y beta globinas. La adición de secuencias que señalizan hacia ribosomas en el UTR también mejora la eficiencia de la traducción de nuestro ARNm vacunal.
3.- Una cabeza 5’ 7-metilguanosina trifosfato (m7G cap; capping). Esta parte tiene dos funciones clave tanto en la estabilidad como en la traducción: por un lado, protege al ARNm de la acción de las exonucleasas 5’-3’ y por otro lado es reconocida por el factor de iniciación de la traducción eIF4E. El capping in vitro con la orientación adecuada es una parte que genera muchos problemas biotecnológicos y de hecho actualmente se opta mayoritariamente por la adición de la cabeza de modo post-transcripcional. Otro método para generar el capping eficiente es la modificación del capping anti-reverso (ARCA) que pueden asegurar la orientación correcta de la cabeza en el extremo 5’, lo que produce mejores uniones a los ribosomas y más traducción.
4.- Una cola 3’ poli(A). Regula la estabilidad y traducción del ARNm de forma sinérgica al capping al interaccionar con una proteína (poly(A) binding protein, PABP) que forma un complejo con eIF4E. Existen diversas formas de añadir esta cola poli(A), desde adicionarla a la hebra molde hasta de forma enzimática post-traduccionalmente mediante la poliadenilación con una poli(A) polimerasa recombinante. La longitud de esta cola es un factor determinante de la eficacia de la formación de los polisomas y por consiguiente la expresión de las proteínas. La longitud óptima está entre 120 y 150 nucleótidos.
Además, hay otras alternativas complementarias para regular la inmunogenicidad de los péptidos generado o que estos ARNm sean más fácilmente reconocidos por receptores reconocedores de patrones como RIG-I, PKR o TLR3, TLR 7 y TLR 8. Así serán internalizados en las células presentadoras de antígenos para su traducción posterior en un contexto claramente coestimulador y activado de la inmunidad. Una de ellas es el uso de pseudouridina () es un isómero del nucleósido uridina (U) muy prevalente en los ARNr, los ARNt y los snRNA y es la modificación más abundante en el ARN celular total, lo que la convierte en el quinto nucleótido del ARN.
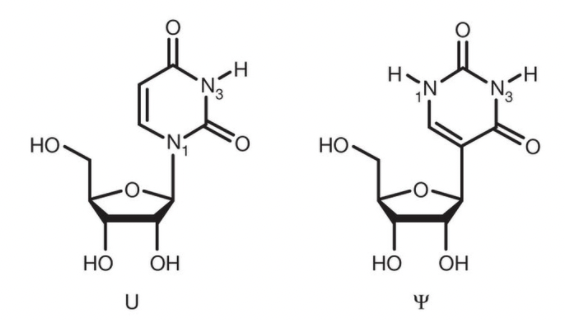
La incorporación de nucleósidos químicamente modificados, como pseudouridina, 1-metilpseudouridina, 5-metilcitidina y otros en el ARNm, generalmente mejorar la traducción al dificultar la detección de este ARNm por los receptores del sistema inmunitario innata (TLR7 y TLR8 principalmente), lo que conduciría también a su inactivación.
Otra modificación para mejorar estos ARNm viene del tipo de construcciones de ARNm. Hemos visto la estructural del ARNm no replicante (NRM) pero existe una alternativa, las construcciones de ARNm autoamplificado (SAM). Ambos tienen una estructura común como la descrita en este apartado, pero la SAM incluye una secuencia derivada de virus de ARNm de cadena positiva (generalmente alfavirus) que inducen en la célula la replicación de estos ARNm y por consiguiente la amplificación de la capacidad de traducción. Este aspecto puede mejorar las vacunas de ARNm del futuro pues sabemos que la expresión in vivo es generalmente posible y suficiente para producir una inmunidad detectable. Sin embargo, generar una respuesta inmune efectiva y, aún más, logrando un efecto terapéutico por medio de ARNm puede ser más exigente en términos de nivel de expresión de proteínas.
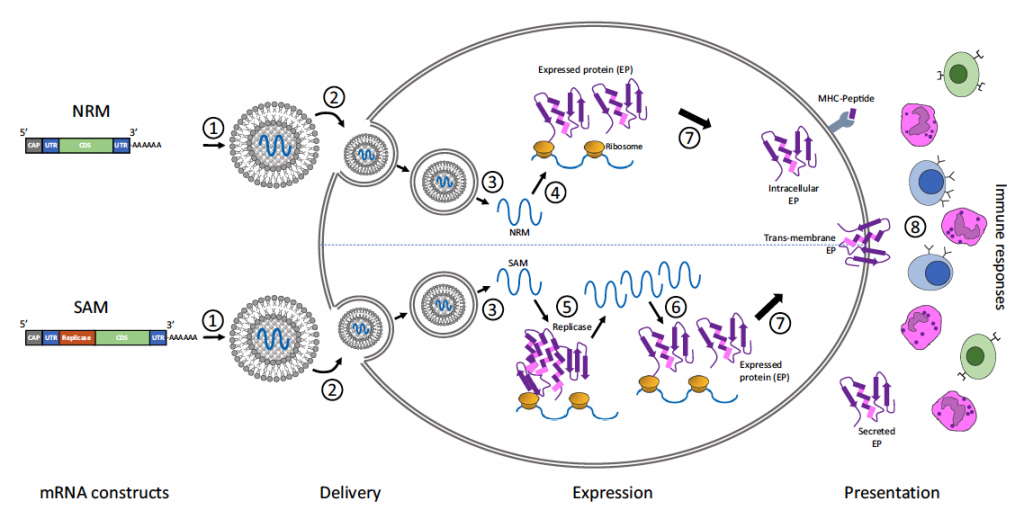
5.- La administración de vacunas de ARNm sin vectores virales
La muestra procedente del sistema ITV contiene el transcrito de ARNm deseado dentro de una mezcla compleja que incluye nucleótidos, oligonucleótidos, fragmentos de transcripción cortos, así como de proteínas. Estos contaminantes deben eliminarse de la muestra mediante una combinación de etapas de precipitación, cromatografía y extracción. Cuanto más puro sea el ARNm obtenido mayor será la eficiencia traduccional de nuestra vacuna. El uso del HPLC para purificar los ARNm es el método que mejores resultados está dando en los modelos preclínicos.
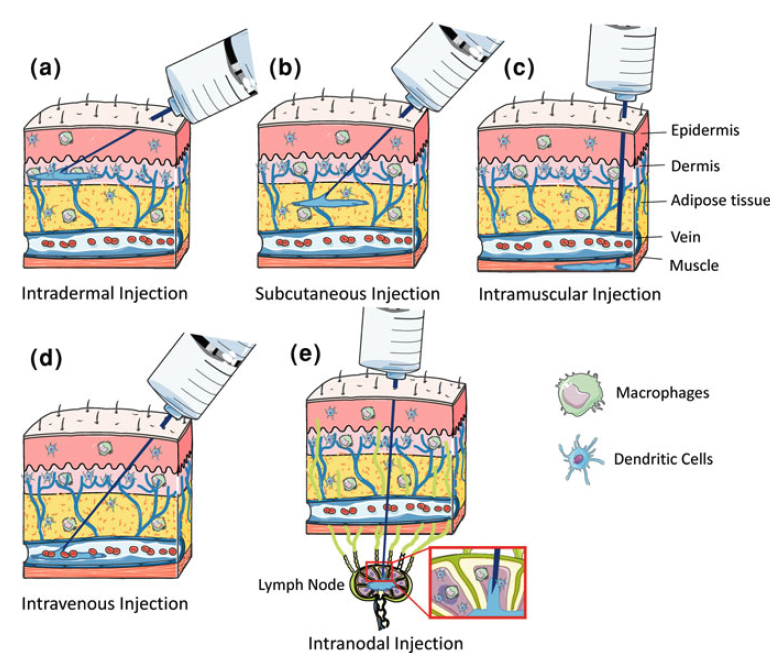
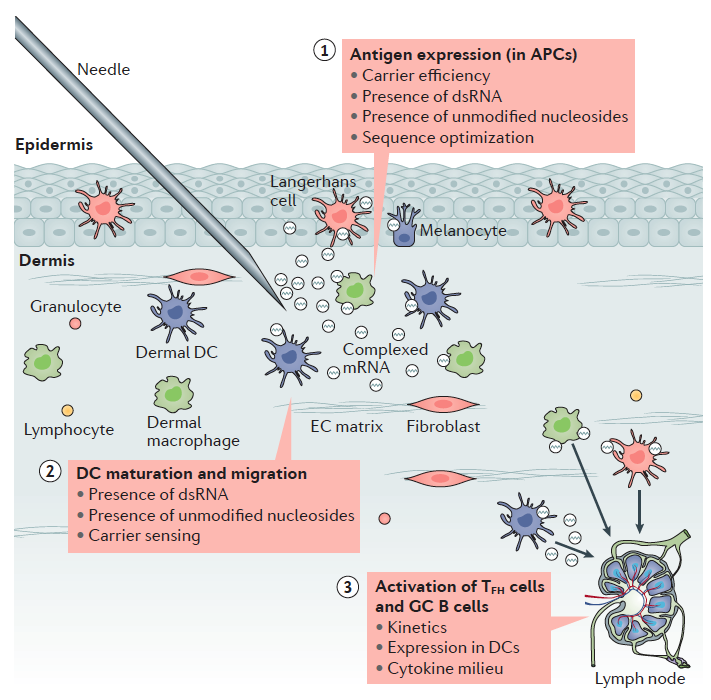
En el apartado anterior hemos visto la importancia de las distintas regiones del ARNm para su estabilidad y su eficiencia en la traducción además de las peculiaridades que supone para su generación los sistemas de ITV. Lugo una vez obtenido el ARNm listo para su uso como vacuna debemos administrarlo a la población y que este sea efectivo activando a las células dendríticas. Hasta la fecha todas estas ventajas estaban asociadas también a una menor eficiencia en las inmunizaciones al estar los ácidos nucleicos poco protegidos y la dificultad intrínseca de hacerlos penetrar en la célula y conseguir la expresión de su información codificada. De hecho, una de las grandes cuestiones es entender y conseguir buenas tasas de penetración en la célula, tras la inyección intramuscular o en las mucosas.
En principio existen dos alternativas para hacer llegar este ARNm a la célula diana, una usando vectores virales y otra prescindiendo de los mismos para ganar en seguridad, reducción de costes y escalabilidad en su producción. Nos vamos a centrar en estos últimos que pueden administrar ese ARNm de tres formas, a saber, desnuda, encapsulada o asociada a adyuvantes. Veamos un poco en detalle los tres.
1.- ARNm desnudo: Numerosos estudios en modelos animales han confirmado que el ARNm desnudo puede transfectar células e inducir respuestas inmunitarias de anticuerpos y células T contra antígenos específicos. Sin embargo, a pesar de algunos resultados iniciales alentadores, las vacunas de ARNm desnudo siguen estando limitadas por la corta vida media del ARNm en el espacio extracelular al ser degradado de forma ubicua por ARNasas. Además, las vacunas de ARN inducen expresión transitoria de proteínas, lo que limita el tiempo de eficacia del tratamiento. Hoy en día para aumentar su eficiencia se usan diversas estrategias como:
- Gene-gun: Para esta alternativa, nanopartículas de oro se recubren con el ARNm, que se inyectan intramuscularmente gracias a una pistola que usa helio presurizado. Este golpe brusco a los tejidos produce significativa necrosis en el lugar de inyección favoreciendo la presencia de DAMPs y la inmunogenicidad de la vacuna.
- Condensación con protamina: consiste en condensar el ARNm con una proteína catiónica pequeña y rica en arginina (protamina). Esta protamina no solo estabiliza al ARNm, sino que actúa como alarmina a través de su reconocimiento por TLR7 y TLR8.
La naturaleza monocatenaria del ARNm permite que el ARNm se pliegue en complejos secundarios y terciarios diferentes del ADN de doble hebra. Su longitud de unos cientos a varios miles de nucleótidos distingue el ARNm de otros ARN monocatenarios como ARN antisentido o aptámeros. Y estas variables se van a asociar a la forma de entrada en la célula. La captación de ARNm desnudo es un fenómeno generalizado
En cultivos primarios y líneas celulares de diversos tipos. La mayor parte del ARNm entra en las células a través de caveolas y balsas lipídicas, muy probablemente mediadas por receptor. En menor grado, la macropinocitosis también parece estar involucrada en la captación de ARNm de células en cultivo y por células dendríticas tras inyección intraganglionar. Paradójicamente, la captación y expresión de ARNm in vivo es bastante más eficiente que la captación espontánea por células in vitro y comparable incluso con células transfectadas in vitro. En parte, la presión hidrodinámica podría contribuir a transfección de células diana en caso de inyecciones por vía local.
2.- Uso de adyuvantes: Además de la inmunogenicidad que ocasionan los dos métodos anteriores, esta se puede incrementar con otros PAMPs y DAMPs para potenciar la capacidad de activación de las células dendríticas. Entre los adyuvantes más usados en estos casos tenemos poly I:C y secuencias CpG. De forma más sofisticada se está trabajando también en inyectar cócteles de ARNm que no solo tuvieran los antígenos de interés sino secuencias que codifican para moléculas coestimuladoras de la célula dendrítica y que aumenten su expresión como CD40L, CD70, OX40L, GITR, o CD83.
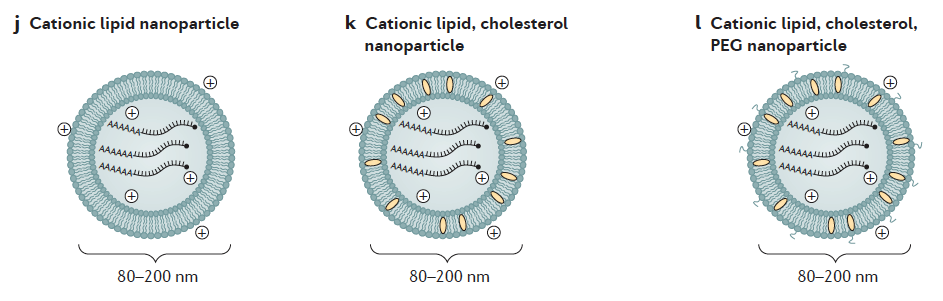
3.- Encapsulación del ARNm: para aumentar su estabilidad y facilitar la penetración del ARNm en la célula se pueden usar liposomas catiónicos. Las formulaciones de nanopartículas lipídicas (LNP) son actualmente la modalidad más prometedora pues sirven para múltiples propósitos. Además de la estabilidad del ARNm gracias a la protección contra la degradación por nucleasas, también facilitan la especificidad del órgano, la captación celular eficiente y proporcionan propiedades de escape endosomal (que lo degradaría) y que mejora dramáticamente la aparición exitosa de la carga de ARNm al citoplasma de la célula.
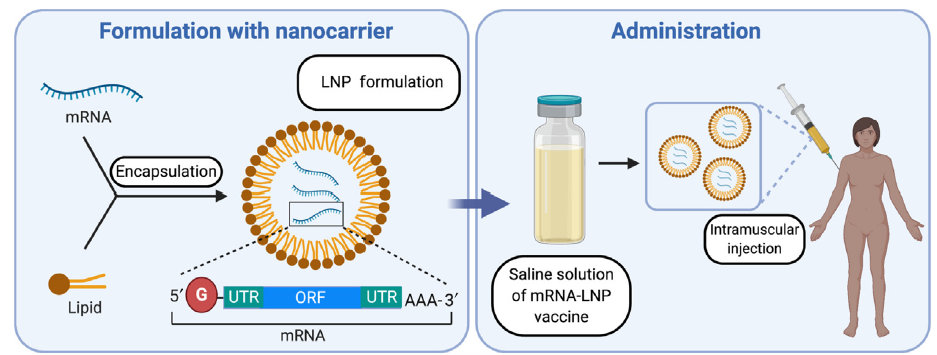
Una de las barreras clave que afecta la eficacia de la transfección general es la degradación endosomal de los LNP de ARNm. Por ello se está haciendo un gran esfuerzo en investigación para modificar y optimizar la transición de la carga de ARNm del endosoma al citosol. Al parecer, el mecanismo que está detrás de la liberación endosómica de ARNm dependería de la mezcla de los lípidos catiónicos de los LNP y los fosfolípidos aniónicos de la membrana endosómica.
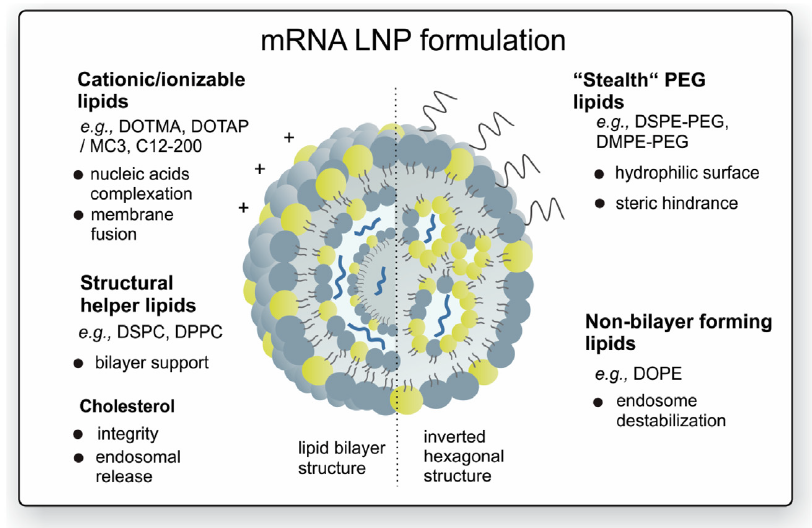
La formación de pares de iones entre estos lípidos desencadenaría una fusión de la membrana y la desestabilización de la membrana, lo que a su vez mejora el escape de moléculas de ARNm de los endosomas.
Además, importante tener en cuenta la vacuna genera productos codificados por ARNm, por lo que son degradados por proteasomas y se presentan en el MHC de clase I a las células T citotóxicas CD8+ y no alcanzan el MHC de clase II, que sería necesario para inducir respuestas de linfocitos helper T CD4+. La adición de una señal de dirección lisosómica a la secuencia que codifica el antígeno puede resultar en una respuesta productiva de células T helper.
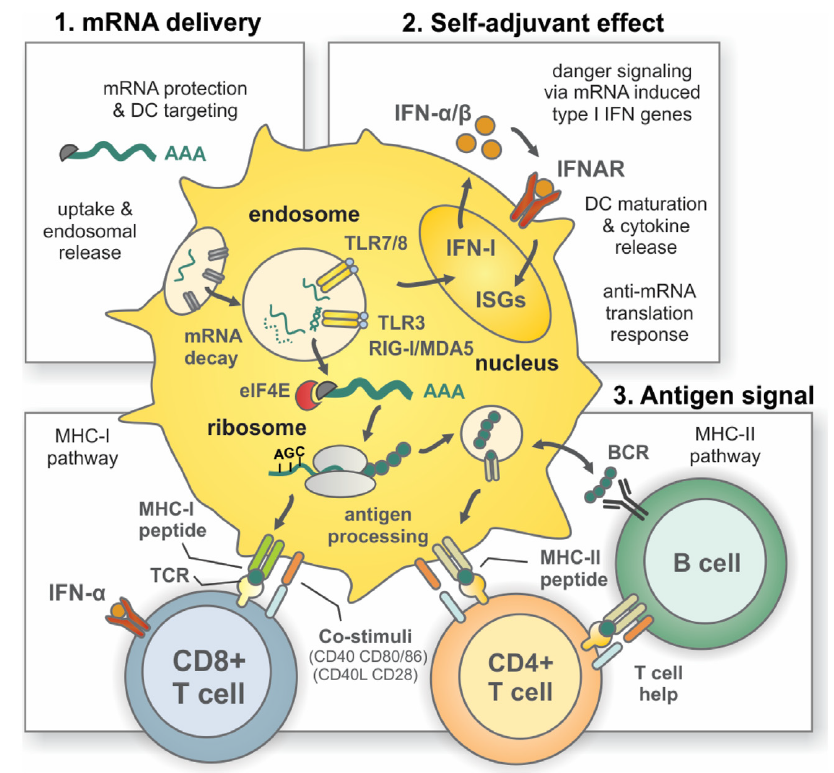
Otro de los aspectos a tener en cuenta es el tipo de celular que va a captar el ácido nucleico para inducir una respuesta inmune. Parece obvio que los miocitos del músculo no serían las mejores células para expresar esos ácidos nucleicos y sería recomendable que lo hicieran las células presentadoras de antígenos, especialmente las células dendríticas. Al parecer el daño tisular asociado a la inyección de la vacuna sería el detonante para la aparición del las alarminas o DAMPs requeridos no solo para captar el ácido nucleico sino para que la célula dendrítica empezara a expresar todo el conjunto de moléculas de coestimulación asociadas a la presentación de antígenos.
6.- Efectos secundarios y estabilidad y limitaciones de las vacunas de ARNm
Los principales desafíos de las vacunas de ARNm en aplicaciones clínicas incluyen su administración in vivo segura y eficiente y su distribución mundial.
La mayor parte de la investigación y ensayo clínico sobre el uso de ARNm para provocar una respuesta inmunitaria hasta ahora se ha centrado en cáncer, para atacar a las proteínas producidas específicamente por los tumores. Sabemos que el uso de ARNm tumoral activa muy eficientemente a las células T citotóxicas y que éstas son las más útil para destruir tumores. En el caso de los virus, sin duda estos linfocitos T serán también importante para destruir las células propias infectadas por el SARS-CoV-2, pero para combatirlo de forma más eficaz, será necesario activar las células B y que produzcan anticuerpos neutralizantes.
En estos momentos hay poca experiencia en este aspecto y comprender si estas vacunas realmente podrán montar una respuesta inmunitaria suficientemente protectora en el ser humano será de vital importancia. Así mismo, otras cuestiones pendientes del desarrollo las iremos vislumbrando a medida que se produzcan las vacunaciones masivas que se están organizando en el mundo entero, como son: determinar qué cantidades de ARNm se necesitarán para lograr la inmunidad; si las proteínas que se han elegido para la vacunas son las adecuadas para prevenir una infección por coronavirus; cuánto tiempo durará cada tipo de inmunidad; si causa efectos secundarios; o si, en el peor de los casos, se agrava la enfermedad.
Como la mayoría de las moléculas de ARNm son susceptibles de ser degradadas por las nucleasas y exhiben una escasa captación celular e inmunogenicidad, como hemos visto, estas requieren amplias modificaciones químicas para mejorar la estabilidad y biodisponibilidad del fármaco. Por ejemplo, las modificaciones de la ribosa como las metilaciones (2′-O-metil) pueden mejorar significativamente la resistencia a las nucleasas y reducir las respuestas inmunitarias innatas. Pero estas modificaciones pueden estar asociadas a efectos secundarios potenciales también. Por ejemplo, estás metilaciones podrían estar asociadas a riesgos de trombocitopenia en algunos sujetos. También pueden causar otras toxicidades no deseadas como la inhibición de ACE2, o por otro lado podrían comportarse como proinflamatorios y aumentar la mortalidad en COVID-19.
Y para terminar, el otro punto determinante es la poca estabilidad de las vacunas da ARNm que obliga a tenerlas que almacenar hasta su uso a muy bajas temperaturas, en concreto -70ºC para la de Pfizer y -20ºC para la de Moderna. Sin ninguna duda este aspecto logístico va a dificultar su uso masivo de forma global pues no todos los países son capaces de garantizar estas condiciones tan exigentes.
En definitiva, tenemos una forma completamente de abordar la vacunación convierte a nuestras propias en factorías que generan las moléculas inmunogénicas del virus. Un sistema que se basa en el uso del ARNm mejorado para ganar estabilidad y penetración en la célula, que se expresa de forma transitoria en las mismas y sin capacidad de integrarse en el genoma, por lo que las hace seguras y eficaces. Un sistema revolucionario y seguro al que solo le queda despejar ciertas incógnitas sobre su eficacia como el tipo de inmunidad que podrá generar y de la duración de la misma.
7.- Referencias
1. Yang J, Arya S, Lung P, Lin Q, Huang J, Li Q. Hybrid nanovaccine for the co-delivery of the mRNA antigen and adjuvant. Nanoscale [Internet]. 2019;11(45):21782–9. Available from: http://dx.doi.org/10.1039/c9nr05475h
2. Zhang C, Maruggi G, Shan H, Li J. Advances in mRNA vaccines for infectious diseases. Front Immunol. 2019;10(MAR):1–13.
3. Zeng C, Zhang C, Walker PG, Dong Y. Formulation and Delivery Technologies for mRNA Vaccines. 2020;
4. Yi C, Yi Y, Li J. mRNA Vaccines: Possible Tools to Combat SARS-CoV-2. Virol Sin. 2020;35(3):259–62.
5. Verbeke R, Lentacker I, De Smedt SC, Dewitte H. Three decades of messenger RNA vaccine development. Nano Today. 2019;28.
6. Schlake T, Thess A, Fotin-mleczek M, Kallen K. Developing mRNA-vaccine technologies. 2012;(November):1319–30.
7. Restifo NP, Ying H, Hwang L, Leitner WW. The promise of nucleic acid vaccines. Gene Ther. 2000;7(2):89–92.
8. Pardi N, Hogan MJ, Porter FW, Weissman D. mRNA vaccines-a new era in vaccinology. Nat Rev Drug Discov [Internet]. 2018;17(4):261–79. Available from: http://dx.doi.org/10.1038/nrd.2017.243
9. McNamara MA, Nair SK, Holl EK. RNA-Based Vaccines in Cancer Immunotherapy. J Immunol Res. 2015;2015.
10. Liu MA. A comparison of plasmid DNA and mRNA as vaccine technologies. Vaccines. 2019;7(2).
11. Le TK, Paris C, Khan KS, Robson F, Ng W-L, Rocchi P. Nucleic acid-based technologies targeting coronaviruses. Trends Biochem Sci [Internet]. 2020;1–15. Available from: https://doi.org/10.1016/j.tibs.2020.11.010
12. Jackson NAC, Kester KE, Casimiro D, Gurunathan S, DeRosa F. The promise of mRNA vaccines: a biotech and industrial perspective. npj Vaccines [Internet]. 2020;5(1):3–8. Available from: http://dx.doi.org/10.1038/s41541-020-0159-8
13. Corbett KS, Edwards DK, Leist SR, Abiona OM, Boyoglu-Barnum S, Gillespie RA, et al. SARS-CoV-2 mRNA vaccine design enabled by prototype pathogen preparedness. Nature [Internet]. 2020;586(7830):567–71. Available from: http://dx.doi.org/10.1038/s41586-020-2622-0

8 comments for “Las vacunas de ARNm, una nueva forma de generar inmunidad contra SARS-CoV-2”