
1.- Introducción
El 4 de enero de 2021 empezó a usarse en el Reino Unido la vacuna de Oxford contra COVID-19, otra forma pionera de generar inmunidad contra SARS-CoV-2. En este inmunensayo os voy a contar:
– que son los vectores virales
– sus pros y cons
– su uso contra coronavirus
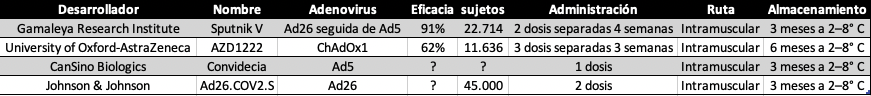
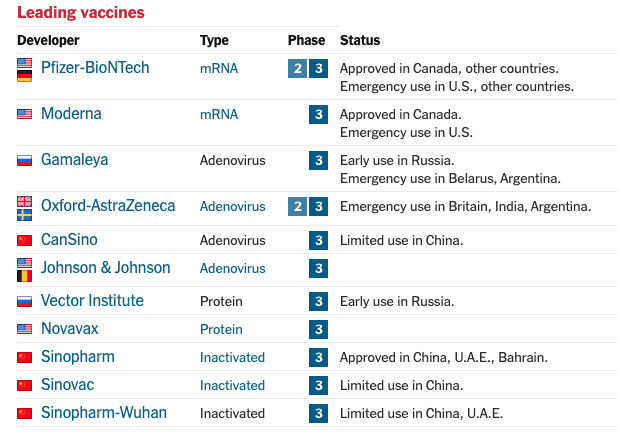
Tan pronto como se publicó en enero de 2020 la secuencia genética del coronavirus, cuatro grupos experimentados en usar virus modificados genéticamente como vectores, una tecnología que tiene más de 30 años, comenzaron a desarrollar vacunas para frenar esta pandemia. Estos grupos que lideran la tecnología de usar un virus contra otro virus son: el Instituto Jenner de la Universidad de Oxford junto con AstraZeneca (UK), CanSino Biologics (China), Johnson & Johnson (USA) y el Instituto Gamaleya (Rusia). La idea es engañar a nuestro organismo para que piense que está infectado por coronavirus y para ello usan como vectores a Adenovirus transformados en el laboratorio como no patogénicos y transgénicos que portan de la información para hacer la famosa proteína Spike del SARS-CoV-2.
Las vacunas con adenovirus han estado muy por detrás de las vacunas de ARNm en las pruebas clínicas y al igual que estas, el objetivo es que nuestras células produzcan ellas mismas la proteína de la envuelta del coronavirus para así entrenar al sistema inmuntario a reconocer y combatir al virus. Aunque en Europa y Norteamérica las vacunas de ARNm han sido las primeras en autorizarse de forma excepcional, realmente en el mundo las vacunas de adenovirus de CanSino y Gamaleya tienen la distinción de haber sido las primeras en usarse en humanos.
- ¿Qué son los adenovirus?
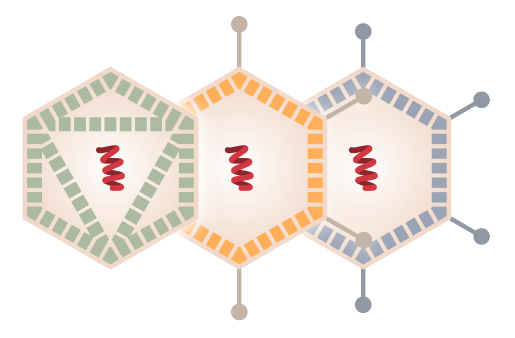
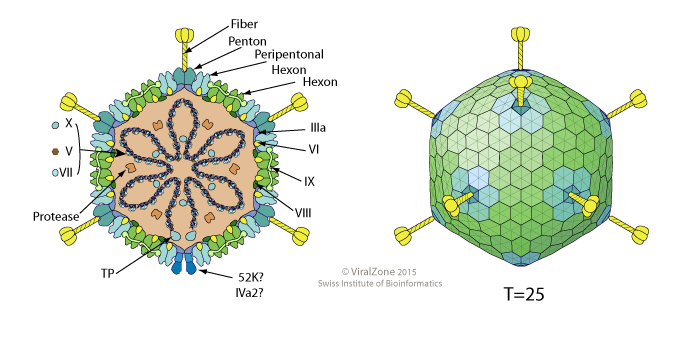
Los Adenovirus son virus sin envoltura (sin bicapa lipídica) con un tamaño de 70-90 nm. Su genoma entre 34-43 kb es de ADN bicatenario (doble hélice). Fueron descubiertos por Rowe en 1953 en las amígdalas humanas (es tejido adenoide y de ahí el nombre del virus). Causan generalmente infecciones leves del tracto respiratorio y gastrointestinal. En humanos se han identificado más de 50 serotipos y además, estos virus están presentes en una amplia variedad de especies de mamíferos, incluyendo los homínidos (en chimpancés hay 6 serotipos).
Se usan adenovirus pues tienen un genoma bien caracterizado por lo que son fáciles de manipular genéticamente y además, al tener un tamaño molecular y génico grande permiten insertar nuevos genes relativamente grandes, lo cual puede ser muy útil y necesario. Hemos de tener en cuenta que como los coronavirus son virus de ARN esta hebra monocatenaria deberemos transformarla en ADN, que es bicatenario, para que forme parte de adenovirus recombinante. Los adenovirus expresan dos tipos de genes: genes tempranos (E) y genes tardíos (L).
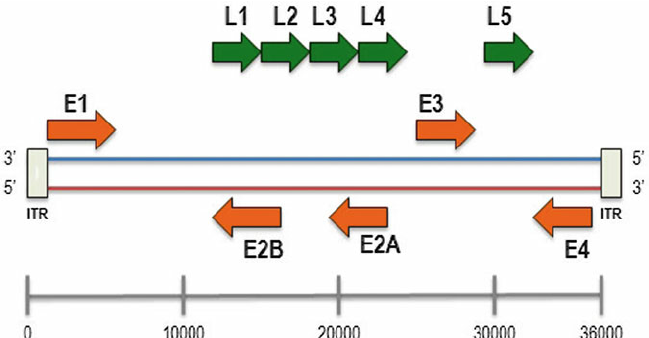
Los genes tempranos (E1a E4) son necesarios para la replicación viral dentro de las células hospedadoras; mientras que los genes L son necesarios para el ensamblaje viral, la lisis de la célula y la posterior liberación del virión. Los adenovirus recombinantes que se generan en el laboratorio como vectores pueden ser de dos formas distintas:
– Virus que se replican de forma poco eficiente y segura y que igualmente codifican la proteína del coronavirus insertada. Al replicarse en teoría aumenta la eficacia vacunal pues aumenta en el individuo el número de virus que infectan a células.
– Virus no replicantes que solo pueden producir las proteínas de coronavirus insertadas en su genoma viral. Si eliminamos el gen E1 se generan adenovirus que son capaces de infectar las células huésped pero que no pueden crecer en número debido a una replicación defectuosa. Sin embargo, en alguno tipos celulares pueden replicarse pues la propia célula proporcionaría funciones similares a E1 en trans (al estar codificado en el genoma humano y no viral).
A diferencia de las vacunas de ARNm estas se consideran probadas y con mayor o menor grado de éxito. Los primeros usos de los Adenovirus como terapia vienen del tratamiento del cáncer. Se les ha encontrado dos utilidades:
– como virus oncolíticos al modificarlos para infectar solamente a las células tumorales e inducir en ellas la muerte celular.
– como inmunoterapia con dos estrategias distintas, una busca insertar genes de citocinas que activen la respuesta inmunitaria en el tumor y la otra estrategia es vacunal, haciendo que porten antígenos tumorales y así ayudar al sistema inmunitario a que reconozca al tumor, se active y lo destruya.
Posteriormente ya vino su uso como agente vacunal en enfermedades infecciosas y actualmente solo está aprobado su uso como vacuna contra la rabia en animales. Aunque en distintas fases clínicas para humanos tenemos vacunas para ébola, sida, malaria, tuberculosis, dengue, gripe y MERS (otro coronavirus). Gracias a la experiencia obtenida anteriormente contra este último se ha podido diseñar tan rápidamente la del SARS-CoV-2.
Las vacunas se preparan insertando un casete transgénico en el esqueleto adenoviral mediante clonación directa o recombinación homóloga. En nuestro el gen que codifica para Spike bajo el control de un promotor fuerte que es capaz de mantener una expresión robusta y sostenida del gen de interés. Veamos este proceso con algo más de detalle.
3. ¿Como se preparan los vectores de adenovirus?
Necesitamos método que nos brinden la capacidad de crecer a títulos muy altos en cultivos celulares los virus, la disponibilidad de líneas celulares certificadas para terapia humana y tecnología para purificación a gran escala. Por ello tres aspectos hay que tener en cuenta, la seguridad, la generación del virus trangénico y su purificación:
Para su seguridad en unas primera generación de vectores se deplecionaban los genes implicados en la realización viral E1 y/o E3. En segundas y terceras generaciones de adenovirus ya se eliminan los cuatro genes implicados, de E1 a E4.
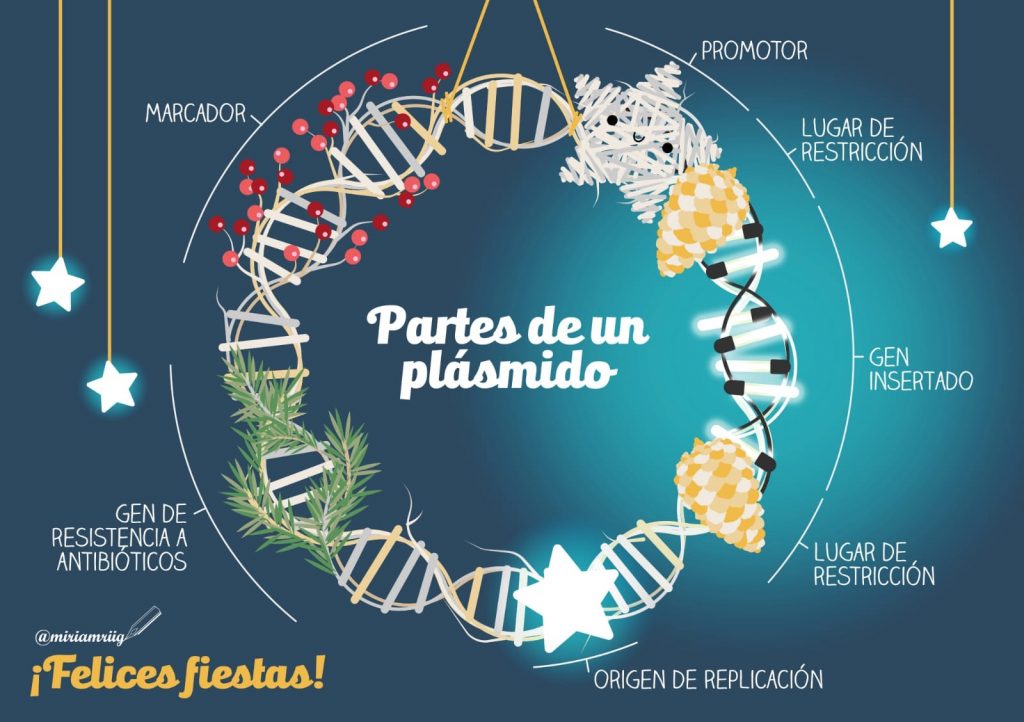
Para realizar el constructo transgénico, clásicamente se utilizaban métodos basado en unir fragmentos de DNA (spike y genoma Adenoviral) tras haberlo digerido con enzimas de restricción. O mediante recombinación homóloga en células usando dos plásmidos (spike y genoma Ad).
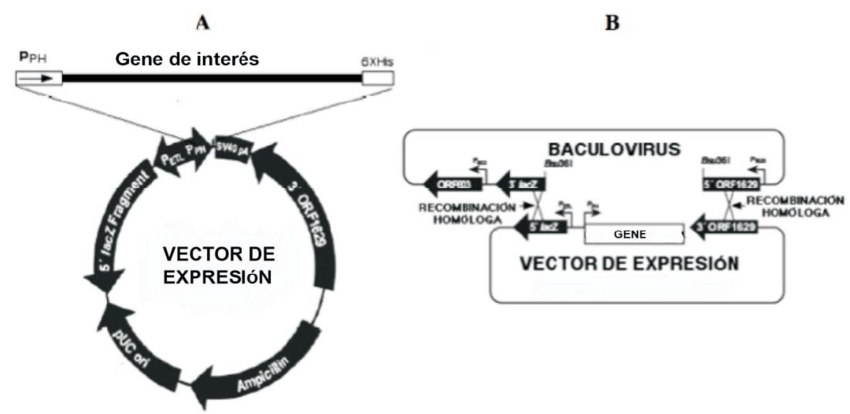
Pero estos métodos tienen limitaciones que pueden solventarse mediante la biotecnología. Y para ello se han usado modelos optimizados con plásmidos en E. coli o con cromosomas artificiales en levaduras (YAC). Aunque las alternativas que más rendimiento proporcionan son las que usan bacteriófagos que contransfectan células que expresan recombinasas.
La producción y su purificación: Para generarlos a pequeña escala bastan la infección de células que se anclan a los frascos de cultivo y la centrifugación de los sobrenadantes de cultivo en gradiente con ClCs. Pero para grandes cantidades y con aplicabilidad clínica hacen falta biorreactores con células humanas embrionarias y la purificación usando diferentes tipos de cromatografías (afinidad, exclusión molecular, etc).

4.- ¿Cuáles son las ventajas y desventajas de las vacunas basadas en adenovirus?
La mayor ventaja aquí es que, los científicos han estado usando esta tecnología en el laboratorio durante décadas. El proceso de inserción de genes en los vectores de adenovirus es rutinario en muchos laboratorios. Implica más pasos que las vacunas de ARNm, pero esos pasos se han optimizado para que aún se puedan realizar con bastante rapidez. Eso hace que este tipo de vacunas sea fácil de fabricar de forma rápida y relativamente económica. Además, una vez ensambladas, las vacunas con vectores de adenovirus son bastante estables, por lo que no es necesario mantenerlas a temperaturas realmente bajas.
Un problema que ha ralentizado el desarrollo de estas vacunas son todos los demás adenovirus presentes en la naturaleza. Muchos no nos enferman y algunos son desconocidos para la ciencia. Los productores de vacunas han estado tratando de encontrar el adenovirus adecuado para usar en la vacuna, uno que su sistema inmunológico no haya visto antes. Si el adenovirus que porta la vacuna se parece demasiado a un adenovirus que su sistema inmunológico ha visto antes, su sistema inmunológico atacará y destruirá la vacuna antes de que tenga la oportunidad de hacer su trabajo. Las empresas llevan años trabajando para solucionar este problema. Al observar los primeros datos de los ensayos de Oxford / AstraZeneca y Johnson y Johnson, se sugiere que pudieron haber tenido éxito.
Empecemos por las ventajas:
– El proceso de inserción de genes en vectores es algo rutinario en el laboratorio. Implica más pasos que las vacunas de ARNm, pero esos pasos se han optimizado para que se puedan realizar con bastante rapidez. Luego se peden fabricar de forma rápida y económica.
– Otra es su seguridad, pues los adenovirus causan infecciones leves en los seres humanos, y como además sabemos inhibir la replicación viral, causan muy pocos efectos secundarios excepto en inmunosuprimidos o con muchas comorbilidades.
– Son virus capaces de infectar una amplia gama de células en división y no división y eso es una gran ventaja a la hora de conseguir infecciones celulares productivas como inmunogénicas.
– Además, presentan un amplio tropismo tisular, centrado principalmente en epitelios respiratorios y digestivos, lo que es una ventaja para su eficacia contra los coronavirus.
– A diferencia de otros vectores virales, como lentivirus y retrovirus, el riesgo de mutagénesis y/o de inserción es muy inferior en el caso de los adenovirus, ya que no integran el genoma viral con el genoma de la célula infectada.
– Tres aspectos logran una alta expresión del antígeno después de la vacunación, a saber: a) que sean de ADN que es muy estable; b) que la biología del virus lo lleve al núcleo celular donde se leen los genes con eficacia; c) los componentes de la casete.
– Su estabilidad, y más si son de virus replicantes consigue, a menudo, que una sola dosis sea suficiente para estimular la protección a largo plazo.
– Los adenovirus poseen patrones moleculares asociados a patógenos (PAMP) para activar el sistema inmunitario innato. El reconocimiento de estos PAMP en la célula infectada conduce a la producción de citocinas inflamatorias y a la maduración de las células presentadoras de antígenos
Ello permite que la inmunidad innata active a la adaptativa pues simulan casi a la perfección la infección natural por lo que generarán respuestas inmunitarias potentes y mantenidas en el tiempo.
– En particular, los adenovirus generan respuestas inmunes celulares mediadas por células T helper (CD4+) y células T citotóxicas (CD8+), lo que las convierte en vectores apropiados para desarrollar vacunas contra patógenos que son eliminados principalmente por linfocitos citotóxicos, que es el caso general de los virus.
– Y ya para terminar las ventajas, dos aspectos logísticos importantes: el primero su mayor termoestabilidad frente a otras vacunas que permite un almacenaje y distribución global más sencilla y accesible
– Y la posibilidad de administración tanto a través de las vías mucosas respiratorias como intramusculares o sistémicas.
Y las desventajas son menores en número pero importantes para su eficacia y disponibilidad:
– Dado que los vectores adenovirales se basan en virus naturales a los que algunos de nosotros ya podríamos haber estado expuestos, es posible que algunas personas pueden tener niveles existentes de protección inmunitaria frente al vector del virus, lo que neutralizaría la vacuna y reduciría su eficacia.
– Hay otro problema potencial. Así como los cuerpos humanos desarrollan respuestas inmunes a la mayoría de las infecciones virales reales, nuestros cuerpos también desarrollan inmunidad a los vectores adenovirales. Eso hace que las inyecciones de refuerzo de las vacunas de vectores adenovirales sean problemáticas. Tras una segunda inyección, nuestros cuerpos desencadenarán un ataque de anticuerpos contra la propia vacuna y no le dejarán hacer su trabajo.
– Otro problema se deriva de la complejidad estructural de la vacuna que lleva un antígeno del coronavirus (el que nos interesa) y muchos otros de las proteínas del adenovirus. Podría ser que en algunos casos el organismo generase una respuesta inmune más potente frente al vector que a la proteína Spike.
– Comparadas on las vacunas de ARNm, la producción más laboriosa y a menor escala de algunas vacunas vectorizadas por virus podría significa que son menos rentables.
- Los adenovirus y su interacción con el sistema inmunitario
La principal desventaja de los Adenovirus (Ad) humanos es que circulan ampliamente, causando el resfriado común, y algunas personas albergan anticuerpos que se dirigirán a la vacuna, haciéndola ineficaz. La inmunidad contra los Ad dura muchos años, por lo que con la edad, una persona acumula inmunidad a más serotipos, así que esas vacunas serán un problema para ello.
Los anticuerpos neutralizantes producidos por infecciones adenovirales o vacunas basadas en adenovirus se dirigen principalmente al hexón de la proteína de la cápside viral; sin embargo, los anticuerpos generados contra la base pentosa o la fibra (otras dos proteínas de la cápside) también pueden neutralizar los adenovirus.
Por suerte hay más de 80 serotipos distintos de Ad, siendo los más usados el Ad5, Ad26 y los de chimpancé. Veamos como los usan los fabricantes de vacunas en fase III:
– CanSino usa el Ad5 y el 40 por ciento de las personas tienen anticuerpos neutralizantes contra Ad5 (en África subsahariana puede llegar al 80-90%). CanSino informó sobre su ensayo de fase II este verano que 266 de los 508 participantes que recibieron la inyección tenían una alta inmunidad preexistente al vector Ad5, y que los participantes mayores tenían una respuesta inmune significativamente menor a la vacuna.
– El subtipo Ad26 es mucho más raro y en Europa y USA solo el 10-20% de las personas albergan anticuerpos y es el que usa J&J.
– La vacuna rusa Sputnik V comienza con una inyección del vector Ad26 seguida de un refuerzo con Ad5.
– Aproximadamente el 1% de las personas tiene anticuerpos contra el adenovirus del chimpancé, probablemente debido a la reactividad cruzada y es la estrategia elegida por la Universidad de Oxford.
6.- La vacuna de Oxford, eficacia y pauta
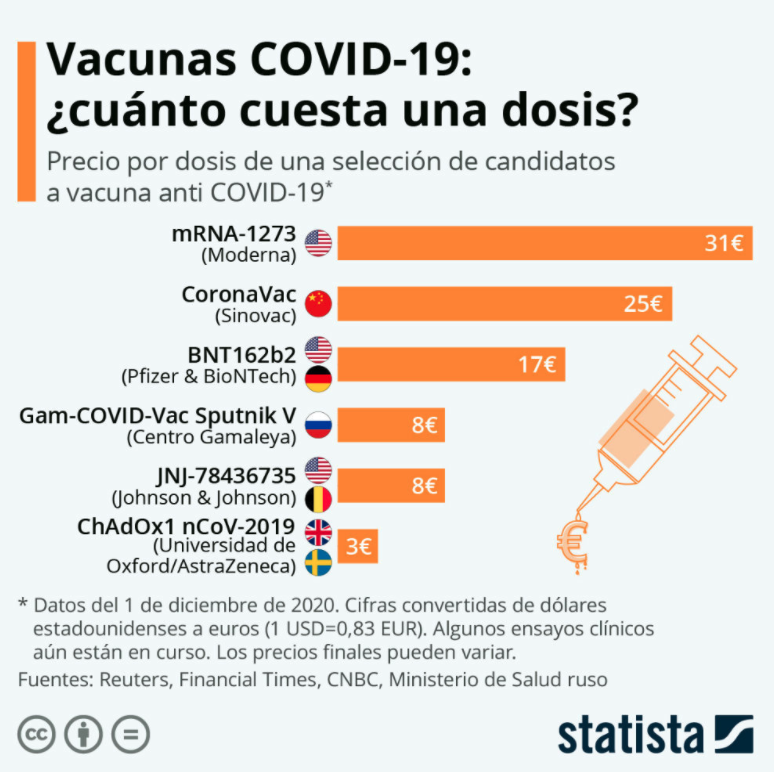
En occidente la que lleva la delantera es la vacuna de Oxford. La batalla entre todas estas vacunas será realmente una batalla logística y la vacuna Oxford tiene una gran ventaja pues se ha hecho con vistas a la accesibilidad universal. Su bajo precio la hace muy atractiva para países en vías de desarrollo y la facilidad de almacenamiento a temperatura de refrigeración convencional, permitirá vacunar a las personas más rápidamente.
Se ha demostrado que la vacuna Oxford es segura y provoca una respuesta inmunitaria en personas de todas las edades, incluidos los mayores de 55 años. Si nos fijamos en los datos del ensayo clínico, los que recibieron dos dosis completas, la efectividad fue del 62%. Pero para un grupo pequeño que recibió por error media dosis y luego una dosis completa, la efectividad fue del 90%. Las agencias reguladoras consideran que una eficacia mayor del 50% es suficiente para autorizarla, aunque evidentemente deja en peor situación para luchar con sus adversarios para posicionarse en el mercado especialmente para escépticos que buscan la máxima eficacia. Por ello AstraZeneca pretende modificar el ensayo para incluir el régimen de dosificación más eficaz, aunque por el momento sin éxito pues la agencia reguladora británica solo ha autorizado dos dosis completas de la vacuna Oxford. Aún no está claro por qué los resultados fueron mejores para este grupo.
Una explicación podría estar en los datos: Los resultados más eficaces de «media dosis, dosis completa» se basaron en 2.741 participantes del ensayo, mientras que el grupo menos eficaz incluyó a 8.895 voluntarios. Luego el ensayo podría no haber sido lo suficientemente grande como para medir las diferencias entre los dos regímenes.
Por otros modelos, sabemos que dosis más bajas de vacuna hacen un mejor trabajo al estimular a los linfocitos T y crean con más eficacia células de memoria.
Es posible que la dosis completa fomentara un mayor número de anticuerpos contra las proteínas del vector y que restara efectividad a la segunda dosis.
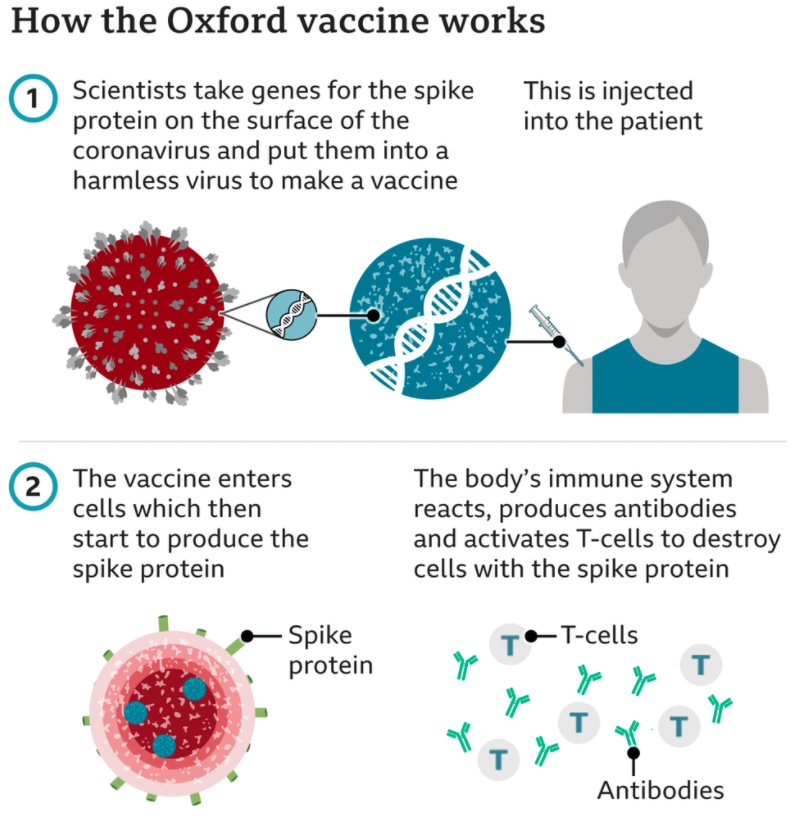
En definitiva, tenemos una nueva forma de vacunar en humanos donde un virus se usa como caballo de troya celular para introducir genes de otro virus y así estimular la respuesta inmunitaria contra el coronavirus. No presentan problemas de seguridad aunque para su eficacia chocan con la posible neutralización del vector por el sistema inmunitario, pudiendo restarles algo de poder vacunal. Las empresas biotecnológicas son conocedoras de las limitación y han establecido mecanismos para poder limitarlos. Esperemos ayuden a controlar esta terrible pandemia.
7. Referencias
- Chen H, Xiang ZQ, Li Y, Kurupati RK, Jia B, Bian A, et al. Adenovirus-Based Vaccines: Comparison of Vectors from Three Species of Adenoviridae. J Virol. 2010;84(20):10522–32.
- Shaw AR, Suzuki M. Immunology of Adenoviral Vectors in Cancer Therapy. Mol Ther – Methods Clin Dev [Internet]. 2019;15(December):418–29. Available from: https://doi.org/10.1016/j.omtm.2019.11.001
- Mahalingam S, Taylor A. From adenoviruses to RNA_ the pros and cons of different COVID vaccine technologies. 2020;1–7.
- Voysey M, Clemens SAC, Madhi SA, Weckx LY, Folegatti PM, Aley PK, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet (London, England) [Internet]. 2020;1–13. Available from: http://www.ncbi.nlm.nih.gov/pubmed/33306989
- Feng L, Wang Q, Shan C, Yang C, Feng Y, Wu J, et al. An adenovirus-vectored COVID-19 vaccine confers protection from SARS-COV-2 challenge in rhesus macaques. Nat Commun [Internet]. 2020;11(1):1–11. Available from: http://dx.doi.org/10.1038/s41467-020-18077-5
- Tatsis N, Ertl HCJ. Adenoviruses as vaccine vectors. Mol Ther [Internet]. 2004;10(4):616–29. Available from: http://dx.doi.org/10.1016/j.ymthe.2004.07.013
- Zhang C, Zhou D. Adenoviral vector-based strategies against infectious disease and cancer. Hum Vaccines Immunother [Internet]. 2016;12(8):2064–74. Available from: http://dx.doi.org/10.1080/21645515.2016.1165908


6 comments for “Las vacunas de adenovirus para COVID-19”