Introducción
Recientemente han salido a la luz algunas publicaciones que vinculan la presencia de autoanticuerpos y manifestación grave de COVID-19. Es el momento de hacer un post explicando estos hallazgos y de paso tranquilizar a la gente que sufre algún tipo de autoinmunidad. Lo vamos a estructural en cuatro partes. Por un lado, vamos a explicar como se genera la inmunidad, que es la autoinmunidad, como los virus pueden generar autoinmunidad y luego ya veremos esos autoanticuerpos y covid.
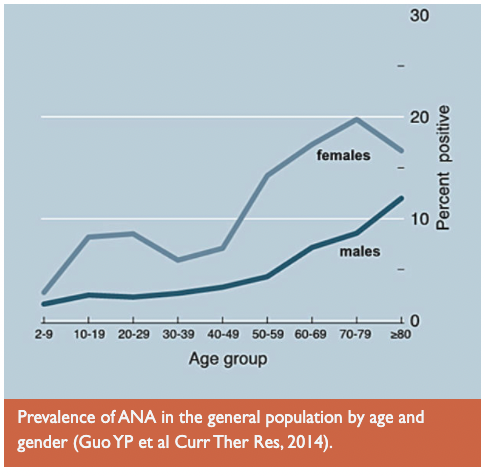
La autoinmunidad es la presencia de anticuerpos y linfocitos autorreactivos que están dirigidos contra algún componente normal de nuestras células o tejidos (autoantígeno) y que provocan alguna dolencia o enfermedad. La autoinmunidad es más frecuente en mujeres que en hombres
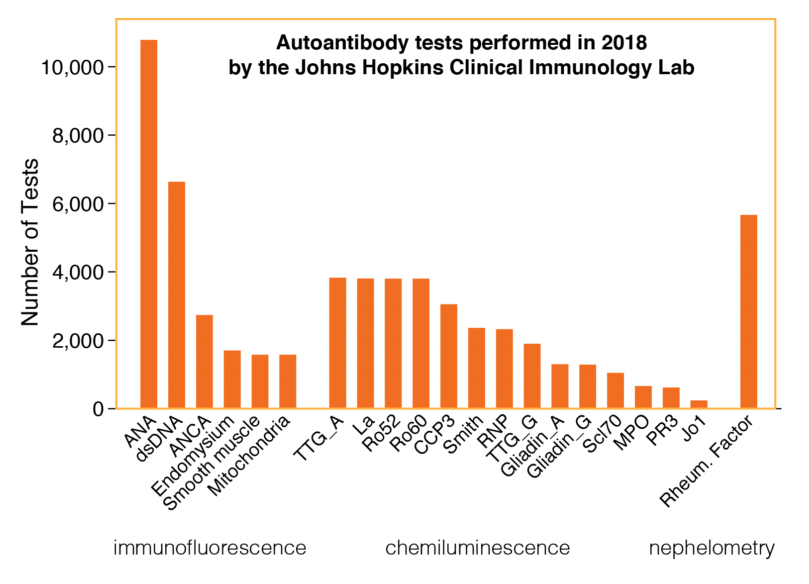
Algo pmuy importante, la presencia de autoanticuerpos no significa tener alguna autoinmunidad. Si no hay manifestaciones clínicas no hay autoinmunidad. Para poder entender como se generan es necesario primero saber como se genera la respuesta inmunitaria.
Como se genera la inmunidad
El sistema inmunitario (SI) cuando se genera durante nuestra vida embrionaria debe ser capaz de reconocer a lo largo de nuestra vida infinidad de componentes moleculares presentes en otra infinidad de microrganismos ambientales y patogénicos. ¿Qué estrategia sigue el SI para poder reconocer todo, hasta lo desconocido? Opta por el camino más sencillo y que es el más eficaz, pero a la vez el más peligroso. Sencillamente se dedica a generar clones de células que son capaces de reconocer cualquier molécula que exista en la naturaleza. Y a ese conjunto de clones linfocitos B (que producen anticuerpos) y T (que o bien coordinan la respuesta inmunitaria y o bien matan células) le denominamos repertorio inmunológico. En otras palabras el repertorio necesita la generación de muchísimos millones de clones generados de manera aleatoria, al azar, para garantizar que seremos capaces de reconocer TODO.
Ya tenemos garantizado que el SI será capaza de reconocer cualquier posible amenaza del individuo en el futuro, pero ese infinito repertorio inmunológico lleva implícito una contrapartida fatal. Y es que se van a generar, ¿por qué no? clones de células que reconocerán a nuestras propias moléculas y querrán destruirnos a nosotros mismos. Y eso no se puede permitir, estos clones se han de destruir. Para eliminarnos tenemos un proceso crucial en nuestro desarrollo embrionario que se denomina tolerancia inmunológica central. Y consiste en lo siguiente. En el timo, un órgano situado tras la parte superior del esternón, en el pecho, los linfocitos son puestos a prueba. La prueba consiste en enseñarles todas y cada una de las moléculas que están presentes en nuestro organismo. Si hay algún linfocito que reconoce a algún autoantígeno este es obligado a morir, mientras que los que no reconocen autoantígenos se les deja sobrevivir.
Pero esta tolerancia central podría no ser perfecta la 100% y como nada se deja ningún fleco sin cubrir pues la autoinmunidad podría ser fatal, además de esta tolerancia central, tenemos otro mecanismo que se denomina tolerancia periférica y que sirve como segunda alternativa para evitar la autoinmunidad. Este se da en lugar de el timo en cualquier parte de organismo y, sin entrar en detalles de su complejidad, detecta reacciones autoinmunes en cualquier tejido e intenta abortarlas. En este proceso no se pueden destruir los linfocitos autorreactivos pero si dejar inactivos a esos clones (ese proceso lo denominamos anergia clonal). Paul Ehrlich acuñó la expresión “horror autotoxicus” (el horror a la autotoxicidad) para justificar que debí existir algún mecanismos que evitara la autoinmunidad o el miedo corporal a la autodestrucción por el sistema inmunitario.
Por qué se produce la autoinmunidad
Este proceso de tolerancia central o periférico es muy eficiente contra la peligrosidad de la generación aleatoria del repertorio inmunológico y ambos funcionan muy bien para evitar la autorreactividad en todos los animales. Pero lamentablemente en aproximadamente un 5% de los humanos en los países desarrollados el sistema falla y se ocasiona alguna enfermedad autoinmune.
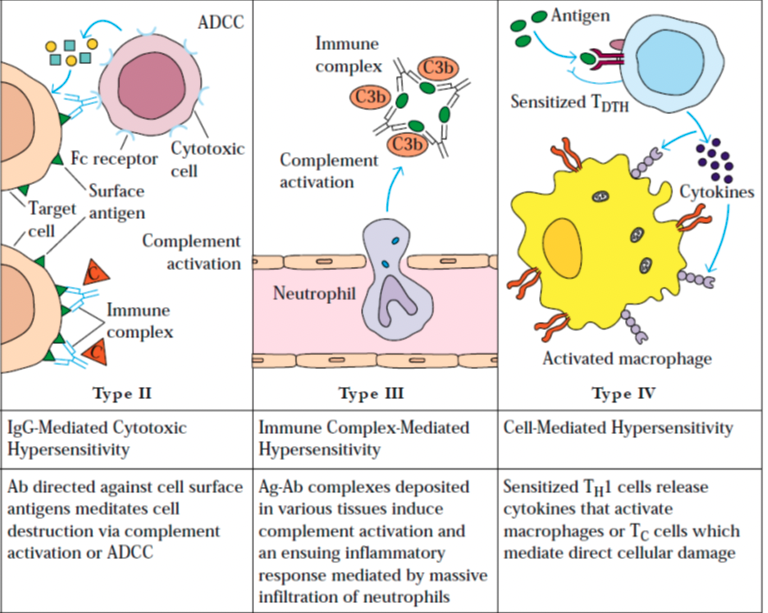
El sistema inmunitario puede atacar a nuestro organismo, de tres formas distintas.
- Anticuerpos de tipo IgG o IgM contra antígenos celulares o tisulares. Sulen ser autoinmunidades focalizadas en dañar un órgano o tejido como puede ser la tiroiditis de Hashimoto o la miastenia gravis. Pero en otros casos se dan efectos paradójicos pues en vez de destruir lo que hacen es sobre-estimular un órgano como en la enfermedad de Graves que es un tipo de hipertiroidismo. Este grupo de autoinmunidades se agrupan dentro de lo que denominamos hipersensibilidades de tipo II o mediadas por anticuerpos
- En otros casos la autoinmunidad genera muchos autoanticuerpos y estos llegan a ser tan abundantes que circulan por la sangre en forma de inmunocomplejos (que son cuando se juntan el autoanticuerpo y el autoantígeno) y se depositan de forma inespecífica en los vasos en cualquier localización y van dañando muchos órganos y tejidos, por lo que decimos que son autoinmunidades sin especificidad de órgano (aunque un órgano que sufre mucho este ataque inespecífico es el riñón pues su microcirculación es muy sensible a los inmunocomplejos). Es la hipersensibilidad de tipo III o mediadas por inmunocomplejos.
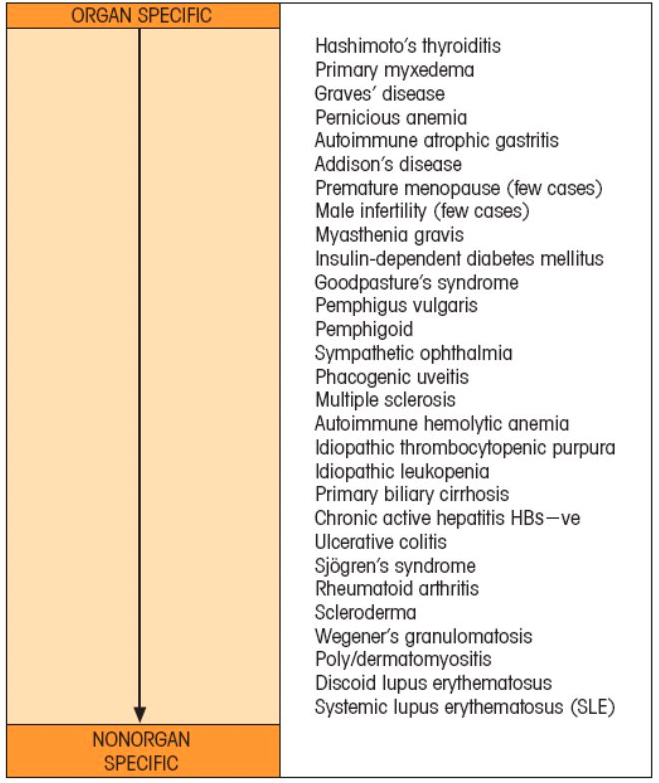
- Por último, hay otra forma de autoinmunidad que no está mediada por autoanticuerpos sino por linfocitos T o macrófagos que destruyen nuestras células. Son específicas de tejido u órgano y un ejemplo es la diabetes de tipo 1 o dependiente de insulina.
Pero, ¿que determina que un sujeto tenga algún tipo de autoinmunidad? ¿Qué papel juegan los virus en esto?
La autoinmunidad es el resultado de un proceso multifactorial en el que entran en juego tanto las características genéticas del individuo como factores ambientales desencadenantes como la presencia de algunos patógenos o inflamaciones e infecciones recurrentes.
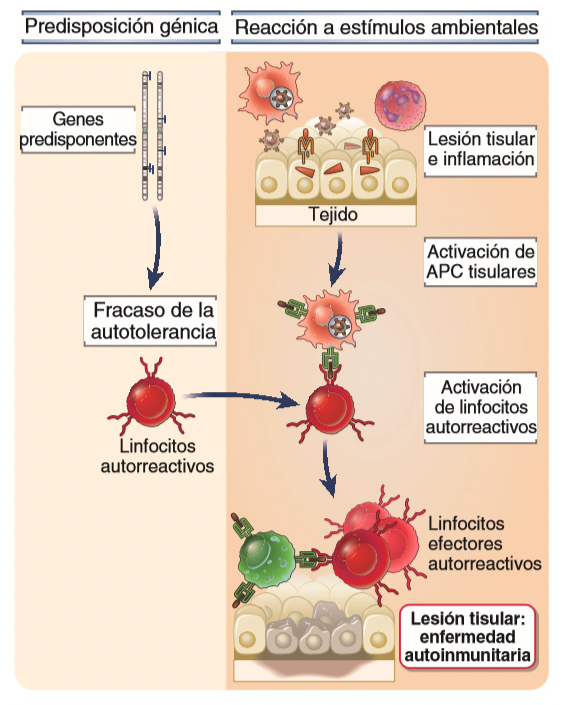
- Sobre el primer aspecto, hay un gen en el cromosoma 21 que se denomina AIRE (autoinmune regulator) que codifica para una proteína que fundamental para ese proceso de tolerancia central que hemos visto y es el principal causante de enfermedad autoinmune. Hay otros genes muy importantes también en el cromosoma 2 como son CTLA4 y PDCD1 o en el cromosoma X denominado FoxP3. Además, los polimorfismos en los alelos del HLA también son una causa muy importante de susceptibilidad a autoinmunidades. Por ejemplo, el 95% de los pacientes con espondilitis anquilosante portan el haplotipo HLA-B27.

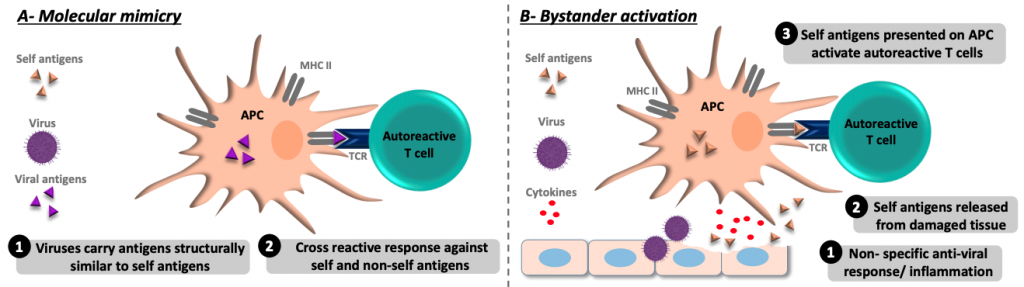
- Sobre el segundo el de los patógenos, tenemos a los virus como principales agentes causales y por dos causas principales, a saber, mimetismo molecular y efecto citopático.
- Mimetismo molecular: Los virus a través de su evolución y para poder infectar mejor a nuestras células ha sabido robar alguno de nuestros genes y engañar mejor a nuestras células. ¿Esto en que se traduce? Pues que algunas personas estos genes virales por lo que denominamos mimetismo molecular (molecular mimicry) se convierten en autoantígenos y desencadenan la inmunidad.
- Efecto citopático: En algunos casos los virus producen la muerte de nuestras células de forma tan masiva que estas pueden liberar demasiados autoantígenos y el mecanismo de tolerancia periférica se ve desbordado y comienza a darse alguna autoinmunidad (bystander activation).
Pero tranquilidad, esto no pasa a todo el mundo y hace faltan que se den otros muchos factores (hemos dicho que era multifactorial) para que al final haya autoinmunidad debida a infecciones virales. En las tablas os pongo dos ejemplos de autoinmunidades muy conocidas como la esclerosis múltiple y la diabetes de tipo 1 y su asociación con ciertos virus.


Los autoanticuerpos y la COVID-19
El papel que juega la respuesta inmunitaria tanto en la protección contra la enfermedad por coronavirus como en contrapartida en la patogenia de la COVID-19 es algo que está sobre la mesa. Y ya tenemos evidencias que los autoanticuerpos podrían estar detrás de algunos de estos problemas tanto a corto como a largo plazo.
- El problema más inmediato es que los autoanticuerpos no dejen al sistema inmunitario hacer su papel fisiológico normal y combatir de forma eficiente el SARS-CoV-2. Desde el mes de septiembre sabemos que en un 10% de los casos de enfermedad grave se podían cuantificar en la sangre autoanticuerpos contra el interferón de tipo 1 (anti-IFN). Ya hemos hablado largo y tendido de los interferones de tipo 1 (alfa y beta) y lo fundamentales que son para que nuestras células se puedan proteger contra los virus (interferón significa que interfiere con la replicación viral). Se puedo objetivar que estos sujetos producían de forma natural anticuerpos anti-IFN antes incluso de padecer la infección por coronavirus pero que el problema se acrecentaba tras la infección. Estos hallazgos tienen una lectura rápida, este tipo de pacientes se beneficiarían de tratamientos con altas dosis de IFN-beta en los primeros momentos de la infección.
- Además, se han cuantificado anticuerpos contra tejidos humanos y estos estarían justificando un problema a largo plazo de la COVID-19 como es el daño a pulmones, corazón, cerebro u otros órganos. Por ejemplo, un estudio ha revelado que el 52% de los hospitalizados tenían autoanticuerpos contra los fosfolípidos, que son componentes básicos de las membranas celulares y además están implicados en la coagulación de la sangre y que explicarían en parte ese problema de coagulación diseminada observado en los casos graves. En otros casos anticuerpos contra la Anexina A, que en componente también de las membranas celulares y explicaría el daño provocado a los pequeños vasos sanguíneos. De la misma forma podemos deducir que tratamientos con inmunosupresores beneficiarían a largo plazo a estos pacientes.
La autoinmunidad y la tolerancia están abriendo nuevos caminos para entender el conjunto de circunstancias que se dan en esta enfermedad tan compleja y que tanta patología postinfección está ocasionando. Algo que hay que dejar claro en este caso en que, en términos generales, tener alguna enfermedad autoinmune diagnosticada no predispone a una mayor severidad de la enfermedad
Referencias
- Smatti, M. K., Cyprian, F. S., Nasrallah, G. K., Al Thani, A. A., Almishal, R. O., & Yassine, H. M. (2019). Viruses and autoimmunity: A review on the potential interaction and molecular mechanisms. Viruses, 11(8), 1–18. https://doi.org/10.3390/v11080762
- Monk, P. D., Marsden, R. J., Tear, V. J., Brookes, J., Batten, T. N., Mankowski, M., Gabbay, F. J., Davies, D. E., Holgate, S. T., Ho, L. P., Clark, T., Djukanovic, R., Wilkinson, T. M. A., Crooks, M. G., Dosanjh, D. P., Siddiqui, S., Rahman, N. M., Smith, J. A., Horsley, A., … Rodrigues, P. M. (2020). Safety and efficacy of inhaled nebulised interferon beta-1a (SNG001) for treatment of SARS-CoV-2 infection: a randomised, double-blind, placebo-controlled, phase 2 trial. The Lancet Respiratory Medicine, 2600(20), 1–11. https://doi.org/10.1016/S2213-2600(20)30511-7
- Rogue antibodies could be driving severe COVID-. Nature (2021). 1–12.
- Zuo, Y., Estes, S. K., Ali, R. A., Gandhi, A. A., Yalavarthi, S., Shi, H., Sule, G., Gockman, K., Madison, J. A., Zuo, M., Yadav, V., Wang, J., Woodard, W., Lezak, S. P., Lugogo, N. L., Smith, S. A., Morrissey, J. H., Kanthi, Y., & Knight, J. S. (2020). Prothrombotic autoantibodies in serum from patients hospitalized with COVID-19. Science Translational Medicine, 12(570). https://doi.org/10.1126/SCITRANSLMED.ABD3876
- Gordon, A. C., Mouncey, P. R., Al-beidh, F., Kathryn, M., Nichol, A. D., Arabi, Y. M., & Annane, D. (2021). Interleukin-6 Receptor Antagonists in Critically Ill Patients with Covid-19 – Writing Committee : Corresponding Author. MedRxiv. https://doi.org/10.1101/2021.01.07.21249390
- Zulfiqar, A.-A., Lorenzo-Villalba, N., Hassler, P., & Andrès, E. (2020). Immune Thrombocytopenic Purpura in a Patient with Covid-19. New England Journal of Medicine, 382(18), e43. https://doi.org/10.1056/nejmc2010472
- Bhattacharjee, S., & Banerjee, M. (2020). Immune Thrombocytopenia Secondary to COVID-19: a Systematic Review. SN Comprehensive Clinical Medicine, 2(11), 2048–2058. https://doi.org/10.1007/s42399-020-00521-8
- Wang, E. Y., Mao, T., Klein, J., Dai, Y., Huck, J. D., Liu, F., Zheng, S., Zhou, T., Israelow, B., Wong, P., Lucas, C., Silva, J., Oh, J. E., Song, E., Perotti, E. S., Fischer, S., Campbell, M., John, B., Wyllie, A. L., … Iwasaki, A. (2020).
- Ehrenfeld, M., Tincani, A., Andreoli, L., Cattalini, M., Greenbaum, A., Kanduc, D., Alijotas-Reig, J., Zinserling, V., Semenova, N., Amital, H., & Shoenfeld, Y. (2020). Covid-19 and autoimmunity. Autoimmunity Reviews, 102597. https://doi.org/10.1016/j.autrev.2020.102597
- Pozzetto, B., Mogensen, K. E., Tovey, M. G., & Gresser, I. (1984). Characteristics of autoantibodies to human interferon in a patient with varicella-zoster disease. Journal of Infectious Diseases, 150(5), 707–713. https://doi.org/10.1093/infdis/150.5.707
- Zuniga, M., Gomes, C., Carsons, S. E., Bender, M. T., Cotzia, P., Miao, Q. R., Lee, D. C., & Rodriguez, A. (2021). Autoimmunity to the Lung Protective Phospholipid-Binding Protein Annexin A2 Predicts Mortality Among Hospitalized COVID-19 Patients. MedRxiv, 2020.12.28.20248807. https://doi.org/10.1101/2020.12.28.20248807
- Bastard, P., Rosen, L. B., Zhang, Q., Michailidis, E., Hoffmann, H. H., Zhang, Y., Dorgham, K., Philippot, Q., Rosain, J., Béziat, V., Manry, J., Shaw, E., Haljasmägi, L., Peterson, P., Lorenzo, L., Bizien, L., Trouillet-Assant, S., Dobbs, K., de Jesus, A. A., … Casanovaa, J. L. (2020). Autoantibodies against type I IFNs in patients with life-threatening COVID-19. Science, 370(6515). https://doi.org/10.1126/science.abd4585

1 comment for “Asociación entre autoanticuerpos y la COVID-19 grave”